Ácido sulfhídrico (H2S): estructura, propiedades, usos, importancia
El ácido sulfhídrico o sulfuro de hidrógeno es un gas formado por la unión de un átomo de azufre (S) y dos átomos de hidrógeno (H). Su fórmula química es H2S. También se le conoce como gas sulfhídrico. Es un gas incoloro cuyo olor se hace evidente en los huevos podridos.
Está presente en los volcanes y en las aguas termales sulfurosas, en el gas natural y en el petróleo crudo. También se forma durante la descomposición anaeróbica (sin oxígeno) de la materia orgánica vegetal y animal. Se produce de forma natural en el organismo de los mamíferos, mediante la acción de ciertas enzimas sobre la cisteína, un aminoácido no esencial.
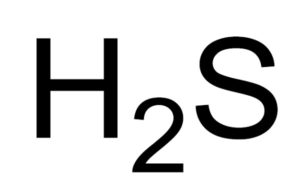
Las soluciones acuosas de H2S son corrosivas para metales como por ejemplo el acero. El H2S es un compuesto reductor que, al reaccionar con el SO2 , se oxida a azufre elemental mientras reduce al SO2 también a azufre.
A pesar de ser un compuesto altamente tóxico y fatal para el ser humano y animales, desde hace algunos años se está estudiando su importancia en una serie de procesos importantes en el organismo.
Regula una serie de mecanismos relacionados con la generación de nuevos vasos sanguíneos y con el funcionamiento del corazón.
Protege las neuronas y se ha pensado en su acción contra enfermedades como el Parkinson y el Alzheimer.
Por su capacidad química reductora puede combatir especies oxidantes actuando así contra el envejecimiento celular. Debido a estas razones se está estudiando la posibilidad de producir fármacos que al ser suministrados a los pacientes lo puedan liberar lentamente dentro del organismo.
Esto serviría para tratar patologías como la isquemia, la diabetes y enfermedades neurodegenerativas. Sin embargo, su mecanismo de acción y su seguridad deben ser aún investigados a profundidad.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades físicas
- 4 Propiedades químicas
- 5 Ubicación en la naturaleza
- 6 Síntesis en el organismo de los mamíferos
- 7 Obtención en el laboratorio o industrialmente
- 8 Uso industrial del H2S para producir azufre
- 9 Utilidad o importancia del H2S endógeno en el organismo
- 10 Riesgos
- 11 Referencias
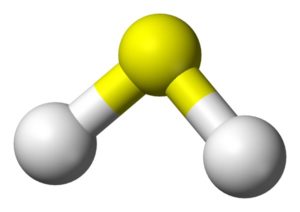
La molécula de H2S es análoga a la del agua, es decir, se parecen en su forma pues los hidrógenos se ubican formando un ángulo con el azufre.
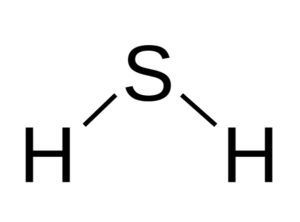
El azufre en el H2S posee la siguiente configuración electrónica:
1s2, 2s2 2p6, 3s2 3p6,
Pues toma prestado un electrón de cada hidrógeno para completar su capa de valencia.
– Ácido sulfhídrico
– Sulfuro de hidrógeno
– Hidruro de azufre.
Gas incoloro de olor muy desagradable.
34,08 g/mol.
-85,60 ºC.
-60,75 ºC.
1,1906 g/L.
Moderadamente soluble en agua: 2,77 volúmenes en 1 de agua a 20 ºC. Puede desalojarse de la solución acuosa de forma completa sometiéndola a ebullición.
Cuando el sulfuro de hidrógeno está en solución acuosa se le asigna el nombre de ácido sulfhídrico. Es un ácido débil. Posee dos protones ionizables:
H2S + H2O ⇔ H3O+ + HS–, Ka1 = 8,9 x 10-8
HS– + H2O ⇔ H3O+ + S2–, Ka2 ∼ 10-14
El primer protón se ioniza ligeramente, como puede deducirse de su primera constante de ionización. El segundo protón se ioniza muy poco, pero las soluciones de H2S contienen algo del anión sulfuro S2–.
Si la solución de H2S se expone al aire, el O2 oxida al anión sulfuro y precipita azufre:
2 S2– + 4 H+ + O2 → 2 H2O + 2 S0↓ (1)
En presencia de cloro Cl2, bromo Br2 y yodo I2 se forma el haluro de hidrógeno correspondiente y azufre:
H2S + Br2 → 2 HBr + S0↓ (2)
Las soluciones acuosas de H2S son corrosivas, producen agrietamiento por estrés con sulfuro en aceros de alta dureza. Los productos de corrosión son sulfuro de hierro e hidrógeno.
El H2S reacciona con el oxígeno del aire y pueden ocurrir las siguientes reacciones:
2 H2S + 3 O2 → 2 H2O + 2 SO2 (3)
2 H2S + O2 → 2 H2O + 2 S0↓ (4)
Reacciona con diversos metales que desplazan al hidrógeno y se forma el sulfuro del metal:
H2S + Pb → PbS + H2↑ (5)
En los gases volcánicos están presentes el H2S y el SO2, los cuales reaccionan entre sí y se forma azufre sólido:
H2S + SO2 → 2 H2O + 3 S0↓ (6)
El sulfuro de hidrógeno no es muy estable, se descompone fácilmente al calentarse:
H2S → H2↑ + S0↓ (7)
Este gas se encuentra de forma natural en los manantiales de aguas termales sulfhídricas o sulfurosas, en los gases volcánicos, en el petróleo crudo y en el gas natural.

Cuando el petróleo (o el gas) contiene trazas significativas de H2S se dice que es “agrio”, en contraste a “dulce”, que es cuando no lo contiene.
Pequeñas cantidades de H2S en el petróleo o en el gas son perjudiciales económicamente debido a que se debe instalar una planta de lavado para removerlo, tanto para prevenir la corrosión como para hacer que el gas residual sea seguro para uso doméstico como combustible.
Se produce siempre que se descompone la materia orgánica que contiene azufre bajo condiciones anaeróbicas (ausencia de aire), como por ejemplo los desechos humanos, animales y vegetales.

Las bacterias presentes en la boca y en el tracto gastrointestinal lo producen a partir de los materiales degradables que contienen los vegetales o las proteínas animales.
Su olor característico hace que se advierta su presencia en los huevos podridos.
El H2S también se produce en ciertas actividades industriales, como en las refinerías de petróleo, los hornos de coque, las fábricas de papel, las tenerías y en el procesamiento de alimentos.
El H2S endógeno se puede producir en los tejidos de los mamíferos, entre estos el ser humano, por dos caminos, uno enzimático y uno no enzimático.
El camino no enzimático consiste en la reducción del azufre elemental S0 a H2S mediante la oxidación de la glucosa:
2 C6H12O6 (glucosa) + 6 S0 (azufre) + 3 H2O → 3 C3H6O3 + 6 H2S + 3 CO2 (8)
El camino enzimático consiste en la producción de H2S a partir de la L-cisteína, el cual es un aminoácido sintetizado por el organismo. El proceso es asegurado por varias enzimas, como la cistationina-β-sintasa y cistationina-γ-liasa, entre otras.

El gas hidrógeno (H2) y el elemento azufre (S) no reaccionan a temperaturas normales ambientales, pero por encima de estas comienzan a combinarse, siendo 310 ºC la temperatura óptima.
El proceso es sin embargo demasiado lento, por lo que se utilizan otros métodos para obtenerlo, entre estos el siguiente.
Se hacen reaccionar sulfuros metálicos (como el sulfuro ferroso) con ácidos (como el clorhídrico) en solución diluida.
FeS + 2 HCl → FeCl2 + H2S↑ (9)
De esta forma se obtiene el gas H2S el cual, dada su toxicidad, debe ser recolectado de forma segura.
El almacenamiento y transporte en grandes cantidades del H2S que se separa del gas natural por lavado con aminas es dificultoso, por ello se utiliza el proceso Claus para convertirlo en azufre.

En dicho proceso ocurren dos reacciones. En la primera el H2S reacciona con el oxígeno para dar SO2, tal como se mencionó anteriormente (ver reacción 3).
La segunda es una reacción catalizada por óxido de hierro donde el SO2 se reduce y el H2S se oxida, y los dos producen azufre S (ver reacción 6).
De esta forma se obtiene azufre el cual puede ser fácilmente almacenado y transportado, así como destinado a múltiples usos.
El H2S endógeno es el que se produce de forma natural en el organismo como parte del metabolismo normal en el ser humano, mamíferos y otros seres vivientes.
A pesar de su reputación de larga data de ser un gas tóxico y venenoso asociado a la descomposición de la materia orgánica, varios estudios recientes desde la década del 2000 hasta el presente han determinado que el H2S endógeno es un regulador importante de ciertos mecanismos y procesos en el ser vivo.
El H2S presenta alta lipofilicidad o afinidad hacia las grasas, por lo que cruza las membranas celulares con facilidad, penetrando en todo tipo de células.
En los mamíferos el ácido sulfhídrico promueve o regula una serie de señales que regulan el metabolismo, la función cardíaca y la supervivencia de la célula.
Ejerce un efecto poderoso en el corazón, vasos sanguíneos y elementos circulantes de la sangre. Modula el metabolismo celular y la función mitocondrial.
Defiende los riñones de los daños producidos por isquemia.
Juega un rol importante como factor protector contra el daño a la mucosa gástrica. Se estima que pueda ser un importante mediador de la motilidad gastrointestinal.
Es probable que esté involucrado en el control de la secreción de la insulina.
Actúa también en funciones importantes del sistema nervioso central y protege las neuronas del estrés oxidativo.

Se estima que puede proteger contra enfermedades neurodegenerativas como el Parkinson, el Alzheimer y la enfermedad de Hungtinton.
Protege las células fotorreceptoras de la retina de la degeneración inducida por la luz.
El H2S por ser una especie reductora puede ser consumido por una variedad de agentes oxidantes que circulan en el organismo. Combate las especies oxidantes como las especies de oxígeno reactivo y las especies de nitrógeno reactivo en el organismo.
Limita las reacciones de los radicales libres a través de la activación de enzimas antioxidantes que protegen contra los efectos del envejecimiento.
La biodisponibilidad del H2S endógeno depende de ciertas enzimas involucradas en la biosíntesis de la cisteína en los mamíferos.
Algunos estudios sugieren que una terapia de fármacos donadores de H2S podría ser beneficiosa para ciertas patologías.
Por ejemplo, podría ser útil en pacientes diabéticos, pues se ha observado que los vasos sanguíneos de animales diabéticos mejoran con fármacos que suministran H2S exógeno.
El H2S suministrado exógenamente aumenta la angiogénesis o formación de vasos sanguíneos, por lo que podría servir para el tratamiento de enfermedades crónicas de isquemia.
Se están ideando fármacos que puedan liberar H2S de forma lenta para poder actuar de forma beneficiosa sobre diversas enfermedades. Sin embargo, la eficacia, seguridad y mecanismos de su acción aún deben ser investigados.
El H2S es un veneno fatal si se inhala puro o incluso diluido 1 parte de gas en 200 partes de aire. Los pájaros son muy sensibles al H2S y mueren incluso en dilución de 1 en 1500 partes de aire.

El H2S es un inhibidor potente de ciertas enzimas y procesos de fosforilación oxidativa, lo que conduce a la asfixia celular. La mayoría de las personas lo percibe olfatoriamente en concentraciones mayores a 5 ppb (partes por billón). Las concentraciones de 20-50 ppm (partes por millón) son irritantes para los ojos y el tracto respiratorio.
Una inhalación de 100-250 ppm por pocos minutos puede generar falta de coordinación, trastornos de la memoria y trastornos motores. Cuando la concentración es de unos 150-200 ppm ocurre la fatiga olfatoria o anosmia, lo que significa que después no se puede detectar el olor característico del H2S. Si se inhala una concentración de 500 ppm por 30 minutos se puede producir edema pulmonar y neumonía.
Las concentraciones de más de 600 ppm pueden ser fatales dentro de los primeros 30 minutos, ya que se paraliza el sistema respiratorio. Y 800 ppm es la concentración que resulta inmediatamente letal para el ser humano.
Debe por lo tanto evitarse que haya escapes de H2S en laboratorios, locales o en cualquier lugar o situación.
Es importante alertar que muchas muertes ocurren porque las personas entran en espacios confinados a rescatar compañeros de trabajo o familiares que han colapsado debido a envenenamiento con H2S, falleciendo ellos también.
Es un gas inflamable.
- Panthi, S. et al. (2016). Physiological Importance of Hydrogen Sulfide: Emerging Potent Neuroprotector and Neuromodulator. Oxidative Medicine and Cellular Longevity. Volume 2016. Article ID 9049782. Recuperado de hindawi.com.
- Shefa, U. et al. (2018). Antioxidant and Cell-Signaling Functions of Hydrogen Sulfide in the Central Nervous System. Oxidative Medicine and Cellular Longevity. Volume 2018. Article ID 1873962. Recuperado de hindawi.com.
- Tabassum, R. et al. (2020). Therapeutic importance of hydrogen sulfide in age-associated neurodegenerative diseases. Neural Regen Res 2020; 15:653-662. Recuperado de nrronline.org.
- Martelli, A. et al. (2010). Hydrogen Sulphide: Novel Opportunity for Drug Discovery. Medicinal Research Reviews. Volume 32, Issue 6. Recuperado de onlinelibrary.wiley.com.
- Wang, M.-J. et al. (2010). Mechanisms of angiogenesis: Role of hydrogen sulphide. Clinical and Experimental Pharmacology and Physiology (2010) 37, 764-771. Recuperado de onlinelibrary.wiley.com.
- Dalefield, R. (2017). Smoke and Other Inhaled Toxicants. Hydrogen Sulfide. In Veterinary Toxicology for Australia and New Zealand. Recuperado de sciencedirect.com.
- Selley, R.C. and Sonnenberg, S.A. (2015). The Physical and Chemical Properties of Petroleum. Hydrogen Sulfide. In Elements of Petroleum Geology (Third Edition). Recuperado de sciencedirect.com.
- Hocking, M.B. (2005). Sulfur and Sulfuric Acid. Claus Process Conversion of Hydrogen Sulfide to Sulfur. In Handbook of Chemical Technology and Pollution Control (Third Edition). Recuperado de sciencedirect.com.
- Lefer, D.J. (2008). Potential importance of alterations in hydrogen sulphide (H2S) bioavailability in diabetes. British Journal of Pharmacology (2008) 155, 617-619. Recuperado de bpspubs.onlinelibrary.wiley.com.
- U.S. National Library of Medicine. (2019). Hydrogen sulfide. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Babor, J.A. y Ibarz, J. (1965). Química General Moderna. 7ª Edición. Editorial Marín, S.A.
