Ácido crómico: estructura, propiedades, obtención, usos
El ácido crómico o H2CrO4 es teóricamente el ácido asociado al óxido de cromo (VI) u óxido crómico CrO3. Esta denominación se debe a que en las soluciones acuosas ácidas del óxido crómico la especie H2CrO4 está presente junto con otras especies de cromo (VI).
El óxido crómico CrO3 también es llamado ácido crómico anhidro. El CrO3 es un sólido de color marrón rojizo o púrpura que se obtiene al tratar soluciones de dicromato de potasio K2Cr2O7 con ácido sulfúrico H2SO4.

Las soluciones acuosas de óxido crómico experimentan un equilibrio de ciertas especies químicas cuya concentración depende del pH de la solución. A pH básico predominan los iones cromato CrO42-, mientras que a pH ácido predominan los iones HCrO4– y dicromato Cr2O72-. Se estima que a pH ácido también esté presente el ácido crómico H2CrO4.
Por su gran poder oxidante las soluciones de ácido crómico se utilizan en química orgánica para efectuar reacciones de oxidación. También se utilizan en procesos electroquímicos para tratar metales de manera que adquieran resistencia a la corrosión y al desgaste.
Ciertos materiales poliméricos también se tratan con ácido crómico para mejorar su adherencia a metales, pinturas y otras sustancias.
Las soluciones de ácido crómico son altamente peligrosas tanto para el ser humano como para la mayoría de los animales y el medio ambiente. Por esta razón, los desechos líquidos o sólidos de procesos donde se utiliza ácido crómico son tratados para eliminar los restos de cromo (VI) o para recuperar todo el cromo presente y regenerar el ácido crómico para reutilizarlo.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Química de las soluciones acuosas donde está presente el ácido crómico
- 5 Obtención
- 6 Usos del ácido crómico
- 7 Recuperación de ácido crómico
- 8 Utilización de microorganismos para sanear efluentes con restos de ácido crómico
- 9 Riesgos del ácido crómico y el óxido crómico
- 10 Referencias
La molécula del ácido crómico H2CrO4 está formada por un ión cromato CrO42- y dos iones hidrógeno H+ unidos a este. En el ion cromato el elemento Cromo se encuentra en un estado de oxidación de +6.
La estructura espacial del ión cromato es tetraédrica, donde el cromo está en el centro y los oxígenos ocupan los cuatro vértices del tetraedro.
En el ácido crómico los átomos de hidrógeno están cada uno junto a un oxígeno. De los cuatro enlaces del cromo con los átomos de oxígeno, dos son dobles y dos son simples, pues estos tienen los hidrógenos unidos a ellos.
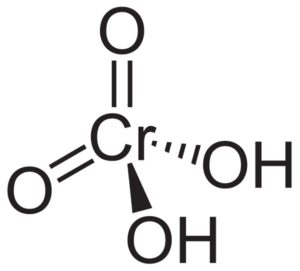
Por otra parte, el óxido crómico CrO3 posee un átomo de cromo en estado de oxidación +6 rodeado de solo tres átomos de oxígeno.
– Ácido crómico H2CrO4
– Ácido tetraoxocrómico H2CrO4
– Óxido crómico (ácido crómico anhidro) CrO3
– Trióxido de cromo (ácido crómico anhidro) CrO3
El ácido crómico anhidro u óxido crómico es un sólido cristalino de púrpura a rojo
CrO3: 118,01 g/mol
CrO3: 196 ºC
Por encima de su punto de fusión es térmicamente inestable, pierde oxígeno (se reduce) para dar óxido de cromo (III) Cr2O3. Se descompone a aproximadamente 250 ºC.
CrO3: 1,67-2,82 g/cm3
El CrO3 es muy soluble en agua: 169 g/100 g de agua a 25 ºC.
Es soluble en ácidos minerales como sulfúrico y nítrico. Soluble en alcohol.
El CrO3 es muy higroscópico, sus cristales son delicuescentes.
Cuando el CrO3 se disuelve en agua forma soluciones fuertemente ácidas.
Es un oxidante muy potente. Oxida vigorosamente la materia orgánica en casi todas sus formas. Ataca la tela, cuero y algunos plásticos. También ataca la mayoría de los metales.
Es fuertemente venenoso y muy irritante debido a su alto potencial oxidante.
El óxido crómico CrO3 se disuelve rápidamente en agua. En solución acuosa el cromo (VI) pueden existir bajo diferentes formas iónicas.
A pH > 6,5 o en solución alcalina el cromo (VI) adquiere la forma de ion cromato CrO42– de color amarillo.
Si se disminuye el pH (1 pH 6,5) el cromo (VI) forma principalmente el ion HCrO4– , el cual puede dimerizar a ion dicromato Cr2O72-, y la solución se vuelve anaranjada. A pH entre 2,5 y 5,5 las especies predominantes son HCrO4– y Cr2O72-.
Los equilibrios que ocurren en estas soluciones al ir bajando el pH son los siguientes:
CrO42- (ion cromato) + H+ ⇔ HCrO4–
HCrO4– + H+ ⇔ H2CrO4 (ácido crómico)
2HCrO4– ⇔ Cr2O72- (ion dicromato) + H2O
Estos equilibrios ocurren solo si el ácido que se añade para bajar el pH es HNO3 o HClO4, pues con otros ácidos se forman compuestos diferentes.
Las soluciones ácidas de dicromato son agentes oxidantes muy enérgicos. Pero en soluciones alcalinas el ion cromato es mucho menos oxidante.
Según las fuentes consultadas una de las formas de obtener el óxido crómico CrO3, esta consiste en añadir ácido sulfúrico a una solución acuosa de dicromato de sodio o potasio, formando un precipitado rojo-anaranjado.

El ácido crómico H2CrO4 se encuentra en las soluciones acuosas de óxido crómico en medio ácido.
Debido a su capacidad fuertemente oxidante, el ácido crómico se ha utilizado desde hace mucho tiempo y con éxito para oxidar compuestos orgánicos e inorgánicos.
Entre innumerables ejemplos se tienen los siguientes: permite oxidar alcoholes primarios a aldehídos y estos a ácidos carboxílicos, alcoholes secundarios a cetonas, tolueno a ácido benzoico, etilbenceno a acetofenona, trifenilmetano a trifenilcarbinol, ácido fórmico a CO2, ácido oxálico a CO2, el ácido láctico a acetaldehído y CO2, ion ferroso Fe2+ a ion férrico Fe3+, ion yoduro a yodo, etc.
Permite la conversión de nitroso-compuestos a nitro-compuestos, sulfuros a sulfonas. Interviene en la síntesis de cetonas partiendo de alquenos, pues oxida los alquenos hidroborados a cetonas.
Compuestos muy resistentes a los oxidantes usuales, como el oxígeno O2 o el peróxido de hidrógeno H2O2, son oxidados por el ácido crómico. Este es el caso de ciertos boranos heterocíclicos.
La anodización con ácido crómico es un tratamiento electroquímico que se aplica al aluminio para protegerlo por muchos años de la oxidación, corrosión y desgaste.
El proceso de anodización involucra la formación electroquímica de una capa de óxido de aluminio o alúmina sobre el metal. Esta capa es luego sellada en agua caliente, con lo cual se consigue la conversión al oxido de aluminio trihidratado.
La capa de óxido sellado es gruesa, pero es estructuralmente débil y no muy satisfactoria para posteriores uniones adhesivas. Sin embargo, al añadir una pequeña cantidad de ácido crómico al agua de sellado se desarrolla una superficie que puede formar buenos enlaces.
El ácido crómico en el agua de sellado disuelve parte de la estructura gruesa tipo celda y deja una capa delgada, fuerte, firmemente sujetada de óxido de aluminio, a la cual los adhesivos se pegan y forman uniones fuertes y duraderas.
La anodización con ácido crómico también se aplica al titanio y sus aleaciones.
El ácido crómico se emplea en procesos de recubrimiento de metales por conversión química.
Durante este proceso, los metales son sumergidos en soluciones de ácido crómico. Este reacciona y disuelve parcialmente la superficie depositando a la vez una capa delgada de compuestos complejos de cromo que interactúan con el metal base.
Este proceso se llama recubrimiento de conversión de cromatos o cromado de conversión.
Los metales que generalmente son sometidos a cromado de conversión son diversos tipos de acero, como el acero al carbono, acero inoxidable y acero recubierto con cinc, y varios metales no ferrosos, como aleaciones de magnesio, aleaciones de estaño, aleaciones de aluminio, cobre, cadmio, manganeso y plata.
Este tratamiento proporciona resistencia a la corrosión y brillo al metal. A mayor pH del proceso mayor resistencia a la corrosión. La temperatura acelera la reacción ácida.
Se pueden aplicar recubrimientos de varios colores, como azul, negro, dorado, amarillo y transparente. También proporciona una mejor adherencia de la superficie metálica hacia pinturas y adhesivos.
Se utilizan soluciones de ácido crómico en la preparación de la superficie de objetos de material termoplástico, polímeros termoestables y elastómeros para su posterior recubrimiento con pinturas o adhesivos.
El H2CrO4 logra un efecto en la química de la superficie y en su estructura, pues ayuda a aumentar su rugosidad. La combinación de picaduras y oxidación aumenta la penetración de los adhesivos e incluso puede ocasionar cambios en las propiedades del polímero.
Se ha empleado para erosionar polietileno ramificado de baja densidad, polietileno lineal de alta densidad y polipropileno.
Se usa mucho en la industria de electro-recubrimiento o galvanoplastia para facilitar la adhesión metal-polímero.
El ácido crómico se emplea como conservante de madera, también en materiales magnéticos y para catálisis de reacciones químicas.
Hay muchos procesos que usan ácido crómico y generan corrientes o residuos que contienen cromo (III) los cuales no se pueden desechar pues tienen iones de cromo (VI) que son muy tóxicos, ni reutilizar porque la concentración de iones cromato es muy baja.
Su disposición requiere la reducción química de los cromatos a cromo (III), seguida de precipitación del hidróxido y filtración, lo que genera costos adicionales.
Por esta razón, se han estudiado diversos métodos para remover y recuperar cromatos. A continuación algunos de estos.
Desde hace muchos años se utilizan las resinas de intercambio iónico para el tratamiento de aguas contaminadas con cromatos. Este es uno de los tratamientos aprobados por la Agencia de Protección Ambiental de los EEUU, o EPA (siglas del inglés Environmental Protection Agency).
Este método permite la recuperación de ácido crómico concentrado puesto que es regenerado nuevamente a partir de la resina.
Las resinas pueden ser de base fuerte o débil. En resinas fuertemente básicas el cromato puede removerse pues los iones HCrO4– y Cr2O72- se intercambian con los iones OH– y Cl–. En resinas débilmente básicas, por ejemplo las de sulfato, los iones se intercambian con los SO42–.
En el caso de las resinas fuertemente básicas R-(OH), las reacciones globales son las siguientes:
2ROH + HCrO4– + H+ ⇔ R2CrO4 + 2H2O
R2CrO4 + 2HCrO4– ⇔ 2RHCrO4 + CrO42-
R2CrO4 + HCrO4– + H+ ⇔ R2Cr2O7 + H2O
Por cada mol de R2CrO4 convertido se remueve un mol de Cr (VI) de la solución, lo que hace a este método muy atractivo.
Luego de la remoción de los cromatos, se trata la resina con una solución fuertemente alcalina para regenerarlos en sitio seguro. Después los cromatos son convertidos a ácido crómico concentrado para ser reusado.
Otro de los métodos es la regeneración electroquímica del ácido crómico, la cual también es una alternativa muy conveniente. Mediante este procedimiento se oxida anódicamente el cromo (III) a cromo (VI). El material del ánodo en estos casos es preferiblemente dióxido de plomo.
Un método que ha sido investigado y aún sigue bajo estudio es la utilización de microorganismos presentes de forma natural en ciertos efluentes contaminados con iones de cromo hexavalente que son los contenidos en las soluciones de ácido crómico.

Tal es el caso de ciertas bacterias presentes en las aguas de desecho de curtido de cuero. Estos microbios se han estudiado y se ha determinado que son resistentes a los cromatos y además son capaces de reducir el cromo (VI) a cromo (III) el cual es mucho menos dañino al ambiente y seres vivos.
Por esta razón, se estima que pueden ser utilizadas como método respetuoso con el ambiente para la remediación y desintoxicación de efluentes contaminados con restos de ácido crómico.
El CrO3 no es combustible pero puede intensificar la combustión de otras sustancias. Muchas de sus reacciones pueden causar fuego o explosión.
El CrO3 y las soluciones de ácido crómico son irritantes potentes de la piel (pueden causar dermatitis), los ojos (pueden quemarlos) y las membranas mucosas (pueden causar broncoasma) y pueden causar los denominados “huecos de cromo” en el sistema respiratorio.
Los compuestos de cromo (VI) como el ácido crómico y el óxido crómico son severamente tóxicos, mutagénicos y carcinógenos para la mayoría de los seres vivos.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- U.S. National Library of Medicine. (2019). Chromic Acid. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wegman, R.F. and Van Twisk, J. (2013). Aluminum and Aluminum Alloys. 2.5. Chromic Acid Anodize Process. In Surface Preparation Techniques for Adhesive Bonding (Second Edition). Recuperado de sciencedirect.com.
- Wegman, R.F. and Van Twisk, J. (2013). Magnesium. 6.4. Preparation of Magnesium and Magnesium Alloys by the Chromic Acid Treatment Processes. In Surface Preparation Techniques for Adhesive Bonding (Second Edition). Recuperado de sciencedirect.com.
- Grot, W. (2011). Applications. 5.1.8. Chromic Acid Regeneration. In Fluorinated Ionomers (Second Edition). Recuperado de sciencedirect.com.
- Swift, K.G. and Booker, J.D. (2013). Surface Engineering Processes. 9.7. Chromating. In Manufacturing Process Selection Handbook. Recuperado de sciencedirect.com.
- Poulsson, A.H.C. et al. (2019). Surface Modification Techniques of PEEK, Including Plasma Surface Treatment. 11.3.2.1. Surface Etching. In PEEK Biomaterials Handbook (Second Edition). Recuperado de sciencedirect.com.
- Westheimer, F.H. (1949). The mechanisms of chromic acid oxidations. Chemical Reviews 1949, 45, 3, 419-451. Recuperado de pubs.acs.org.
- Tan, H.K.S. (1999). Chromic Acid Removal by Anion Exchange. The Canadian Journal of Chemical Engineering, Volume 77, February 1999. Recuperado de onlinelibrary.wiley.com.
- Kabir, M.M. et al. (2018). Isolation and characterization of chromium(VI)-reducing bacteria from tannery effluents and solid wastes. World Journal of Microbiology and Biotechnology (2018) 34:126. Recuperado de ncbi.nlm.nih.gov.
