Compuestos binarios: formación, tipos, ejemplos, nomenclatura
Los compuestos binarios son todos aquellos formados por dos elementos químicos, independientemente del número de sus átomos o de sus interacciones. La fórmula general para estos compuestos es AnBm, donde A y B son dos elementos distintos de la Tabla Periódica, y n y m sus respectivos coeficientes estequiométricos.
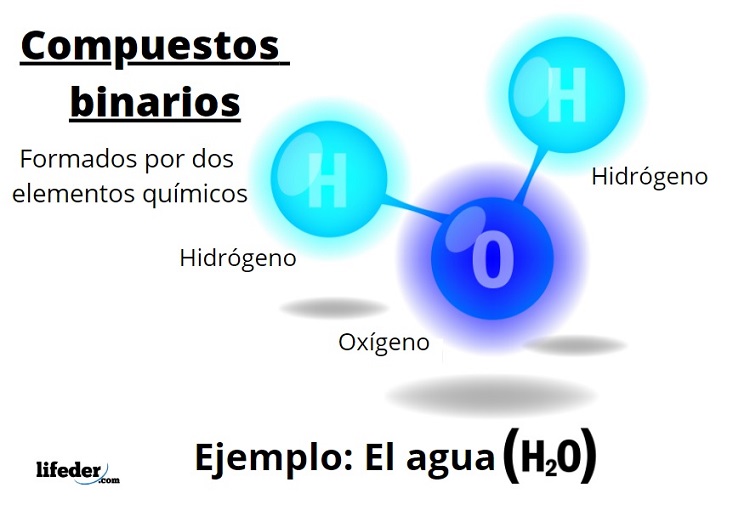
Por ejemplo, el agua, H2O, es un compuesto binario, siendo quizás el más representativo de ellos. El agua está formada por hidrógeno, H, y oxígeno, O, sumando así dos elementos químicos. Nótese que sus coeficientes estequiométricos indican que hay dos átomos de hidrógeno y uno de oxígeno, pero sigue siendo todavía un compuesto binario.
Los compuestos binarios pueden constar de iones, moléculas, redes tridimensionales, o incluso de átomos metálicos neutros. Lo importante es que cualquiera sea la naturaleza de su enlace químico o su composición, esté formado siempre por dos elementos químicos diferentes. Por ejemplo, el gas hidrógeno, H2, no cuenta como compuesto binario.
Los compuestos binarios quizás no parezcan, en un principio, tan abundantes y complejos en comparación a los compuestos ternarios o cuaternarios. Sin embargo, entre ellos figuran muchas sustancias imprescindibles para los ecosistemas terrestres, tales como las sales, los óxidos, los sulfuros, y algunos gases de inmenso valor biológico e industrial.
Índice del artículo
- 1 ¿Cómo se forman los compuestos binarios?
- 2 Nomenclatura
- 3 Tipos: clasificación de los compuestos binarios
- 4 Ejemplos de compuestos binarios
- 5 Referencias
Los métodos de preparación o las rutas sintéticas para formar los compuestos binarios dependerán de las identidades de los dos elementos químicos A y B. No obstante, en principio y de manera general, ambos elementos deben combinarse en un reactor para que puedan interactuar entre sí. Así, si las condiciones son favorables, tendrá lugar una reacción química.
Habiendo una reacción química, los elementos A y B se unirán o enlazarán (iónica o covalentemente) para formar el compuesto AnBm. Muchos compuestos binarios pueden formarse mediante la combinación directa de sus dos elementos puros, o bien siguiendo otros métodos alternativos más viables económicamente.
Volviendo al ejemplo del agua, el hidrógeno, H2, y el oxígeno, O2, se combinan a altas temperaturas para que haya una reacción de combustión entre ellos:
2H2(g) + O2(g) → 2H2O(g)
El agua, por otro lado, puede obtenerse mediante reacciones de deshidratación de compuestos tales como los alcoholes y azucares.
Otro ejemplo de formación de un compuesto binario corresponde al sulfuro ferroso, FeS:
Fe(s) + S(s) → FeS(s)
Donde esta vez, tanto el hierro como el azufre son sustancias sólidas y no gaseosas. Y así ocurre igual con varias sales binarias, por ejemplo, cloruro de sodio, NaCl, combinando el sodio metálico con los gases de cloro:
2Na(s) + Cl2(g) → 2NaCl(s)
Los nombres de todos los compuestos binarios se rigen en su mayoría por las mismas reglas.
Para el compuesto AnBm, se menciona primero el nombre del elemento B en su forma aniónica; esto es, con la terminación –uro. Sin embargo, para el caso de que B consista de oxígeno, se nombra como un óxido, peróxido u superóxido según aplique.
El nombre de B viene precedido por los prefijos numerales griegos (mono, di, tri, tetra, etc.) de acuerdo al valor de m.
Finalmente, se menciona el nombre del elemento A. En el caso de que A posea más de una valencia, esta se indica con números romanos y entre paréntesis. O si se prefiere, puede optarse por la nomenclatura tradicional y usar los sufijos –oso e –ico. El elemento A en ocasiones también viene precedido por los prefijos numerales griegos según el valor de n.
Considérese los siguientes compuestos binarios juntos con sus respectivos nombres:
-H2O: óxido de hidrógeno o monóxido de dihidrógeno (este último nombre es motivo de burlas)
-FeS: sulfuro de hierro (II) o sulfuro ferroso
-NaCl: cloruro de sodio o cloruro sódico
-MgCl2: cloruro de magnesio, cloruro magnésico, o dicloruro de magnesio
Nótese que no se dice ‘cloruro de monosodio’ ni ‘sulfuro de monohierro’.
Los compuestos binarios se clasifican según de qué estén formados o hechos: iones, moléculas, átomos metálicos o redes. Aun así, dicha clasificación no es del todo concluyente o definitiva, pudiendo variar dependiendo del enfoque considerado.
En los compuestos binarios iónicos, A y B constan de iones. Así, para el compuesto AnBm, B suele ser un anión, B–, mientras A un catión, A+. Por ejemplo, el NaCl pertenece a esta clasificación, así como todas las sales binarias, cuyas fórmulas generales se representan mejor como MX, donde X es un anión, y M un catión metálico.
Así, los fluoruros, cloruros, bromuros, yoduros, hidruros, sulfuros, arseniuros, óxidos, fosfuros, nitruros, etc., pertenecen también a esta clasificación. Sin embargo, cabe destacar que algunos de ellos son covalentes, perteneciendo por lo tanto a la siguiente clasificación.
Los compuestos binarios covalentes están formados por moléculas. El agua pertenece a esta clasificación, pues consta de moléculas H-O-H. El cloruro de hidrógeno, HCl, también se considera un compuesto binario covalente, ya que consta de moléculas H-Cl. Nótese que el NaCl es iónico, mientras que el HCl es covalente, siendo ambos cloruros.
Los compuestos binarios también abarcan las aleaciones y los sólidos de redes tridimensionales. No obstante, para ellos suele usarse mejor la denominación de materiales binarios.
Por ejemplo, el latón, más que un compuesto, se considera un material o aleación binarios, pues está formado por cobre y zinc, Cu-Zn. Nótese que no se escribe CuZn por no poseer coeficientes estequiométricos definidos.
Asimismo, se tiene el dióxido de silicio, SiO2, formado por silicio y oxígeno. Sus átomos se enlazan definiendo una red tridimensional, donde no se puede hablar de moléculas ni tampoco de iones. Muchos nitruros, fosfuros y carburos, cuando no son iónicos, se tratan también de este tipo de redes.

Se enlistará para finalizar varios compuestos binarios acompañados de sus respectivos nombres:
-LiBr: bromuro de litio
-CaCl2: cloruro de calcio
-FeCl3: cloruro de hierro (III) o cloruro férrico
-NaO: óxido de sodio
-BeH2: hidruro de berilio
-CO2: dióxido de carbono
-NH3: trihidruro de nitrógeno o amoníaco
-PbI2: yoduro de plomo (II) o diyoduro de plomo
-Mg3N2: nitruro de magnesio
-Al2O3: óxido de aluminio o trióxido de dialuminio
-Na3P: fosfuro de sodio
-AlF3: fluoruro de aluminio
-RaCl2: cloruro de radio o dicloruro de radio
-BF3: trifluoruro de boro
-RbI: yoduro de rubidio
-WC: carburo de tungsteno o wolframio
Cada uno de estos ejemplos puede tener más de un nombre a la vez. De ellos, el CO2 tiene un gran impacto en la naturaleza, pues es utilizado por las plantas en el proceso de fotosíntesis.
Por otro lado, el NH3 es una de las sustancias con más valor industrial, necesaria para sinfines de síntesis poliméricas y orgánicas. Y finalmente, el WC es uno de los materiales más duros jamás creados.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Artem Cheprasov. (2020). What is a Binary Compound? – Definition & Examples. Study. Recuperado de: study.com
- Helmenstine, Anne Marie, Ph.D. (11 de febrero de 2020). Definition of Binary Compound. Recuperado de: thoughtco.com
- Byju’s. (2020). What are Binary Compounds? Recuperado de: byjus.com
- ChemTeam. (s.f.). Binary Compounds of Metals with Fixed Charges. Recuperado de: chemteam.info
- Wikipedia. (2020). Binary phase. Recuperado de: en.wikipedia.org
