Nitritos: propiedades, estructura, nomenclatura, formación
Los nitritos son todos aquellos compuestos que contienen el anión NO2–, si son inorgánicos, o el grupo –ONO, si son orgánicos. La inmensa mayoría se trata de nitritos metálicos, los cuales son sales inorgánicas donde el NO2– interacciona electrostáticamente con cationes Mn+; por ejemplo, el catión sodio, Na+.
Así, el nitrito de sodio, NaNO2, es un ejemplo de una sal o compuesto de nitrito. Estas sales se encuentran en la naturaleza, ya sea en los suelos, mares, mamíferos y tejidos vegetales, pues forman parte del ciclo biológico del nitrógeno. Por lo tanto, el NO2– es una sustancia presente en nuestros organismos, y se le vincula con procesos vasodilatadores.
El nitrito viene a ser una forma de nitrógeno más reducida, o menos oxidada, que el nitrato, NO3–. De él se produce el óxido nítrico, NO, en regiones del organismo donde hay deficiencia de oxígeno. El NO es una molécula de señalización la cual ejerce un efecto vasodilatador al relajar los músculos y las arterias.
Fuera de la bioquímica y la medicina, los nitritos se usan como bactericidas, siendo su agregación a las carnes de uso bastante común. Esto con el propósito de curarlas y prolongar por más tiempo su calidad y frescura.
El nitrito tiene dos rostros: uno beneficioso para la salud, y otro que la pone en peligro. El rostro bueno se debe precisamente a las reacciones que lo reducen a NO. Mientras, el rostro malo se debe a su transformación a nitrosamina: una familia de compuestos orgánicos que tiene varios miembros a los que se les ha reconocido como sustancias cancerígenas.
Índice del artículo
- 1 Propiedades de los nitritos
- 2 Estructura
- 3 Nomenclatura
- 4 Formación
- 5 Aplicación de los nitritos
- 6 Ejemplos de nitritos
- 7 Referencias
Los nitritos son sales básicas, pues el anión NO2– es la base conjugada del ácido nitroso, HNO2:
HNO2 + H2O ⇌ NO2– + H3O+
En agua y en pocas cantidades se hidroliza para originar iones OH–:
NO2– + H2O ⇌ HNO2 + OH–
Esta basicidad es intrínseca para todas las sales de nitrito, ya que depende del NO2– y no de los cationes que lo acompañan. Sin embargo, estos cationes y sus interacciones con el NO2– sí afectan las solubilidades de las sales de nitrito en el agua y otros solventes polares.
Las reacciones de los nitritos varían dependiendo de qué cationes acompañan al NO2–, o de si se trata de un nitrito orgánico, RONO. En términos generales, los nitritos pueden descomponerse, oxidarse o reducirse a: óxidos metálicos, NO3–, NO2, NO, e inclusive gas nitrógeno, N2.
Por ejemplo, el nitrito de amonio, NH4NO2 puede descomponerse a N2 y H2O.
Casi todos los nitritos son sólidos de apariencia cristalina. Muchos son de colores blanquecinos o amarillentos, aunque los hay coloridos si contienen cationes de metales de transición.
Por otro lado, los nitritos orgánicos en su mayoría son líquidos volátiles altamente inestables y explosivos.
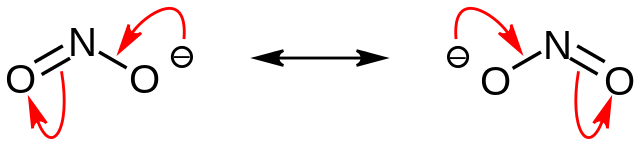
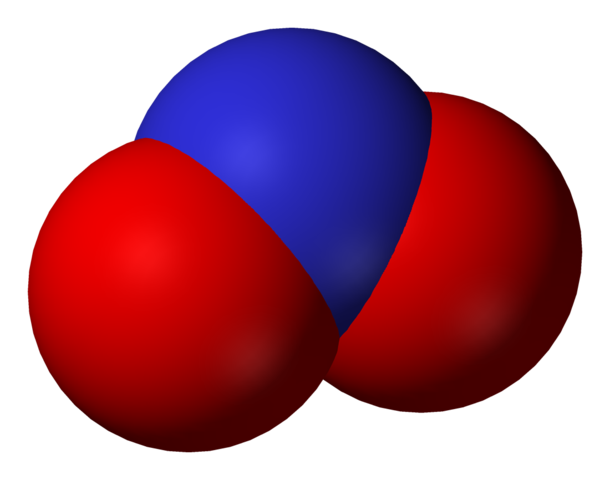
En la primera imagen se mostró el anión nitrito con un modelo de espacio lleno. Este modelo tiene la desventaja que es exactamente el mismo que el del dióxido de nitrógeno, NO2. En cambio, la imagen superior describe mejor el anión nitrito y cómo se comporta su carga negativa.
Esta carga se deslocaliza entre los dos átomos de oxígeno, por lo que cada uno posee la mitad de dicha carga negativa (-1/2). Y es esta carga negativa la responsable de atraer cationes de los alrededores por simple atracción electrostática.
Los nitritos inorgánicos son todos compuestos sólidos cristalinos. Sus interacciones son puramente electrostáticas, habiendo una atracción entre el NO2– y los cationes Mn+. Así por ejemplo, el NaNO2 tiene una estructura cristalina ortorrómbica, y está formada por iones Na+ y NO2–.
El tipo de estructura cristalina dependerá de la identidad de M+n, por lo que no todos los nitritos comparten una estructura ortorrómbica.
Los nitritos orgánicos, a diferencia de los inorgánicos, no son compuestos iónicos sino covalentes. Están formados por lo tanto de moléculas, las cuales se caracterizan por tener un enlace R-ONO, donde R puede ser un grupo alquílico o aromático.
Se consideran ésteres del ácido nitroso, pues su hidrógeno, H-ONO, se sustituye por un grupo R:
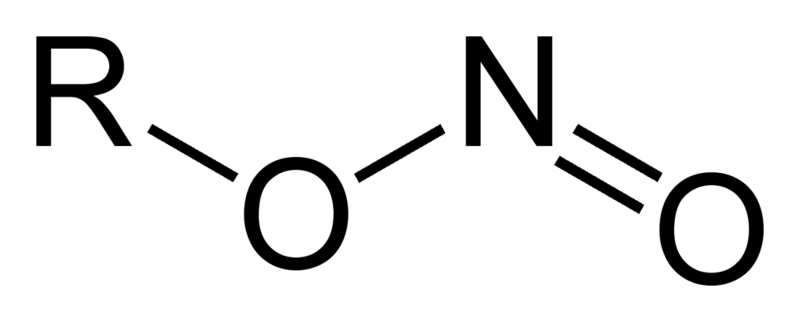
Según la imagen superior, este éster pudiera escribirse como RON=O, muy similar a la fórmula de los ésteres de carbono, ROC=O. Nótese el gran parecido que tiene esta estructura con la de los compuestos nitro, RNO2, donde ahora el enlace principal es R-NO2 y no R-ONO. La única diferencia radica por lo tanto en el átomo con que se une NO2 al grupo R.
Es por esta razón que los ésteres de nitrito y los compuestos nitro se consideran isómeros de enlace, pues tienen los mismos átomos, pero enlazados de manera distinta.
Los complejos de nitrito pueden tener tanto componentes inorgánicos como orgánicos. En ellos se forma un enlace de coordinación entre un centro metálico y uno de los oxígenos del NO2–. Es decir, no se habla de una interacción puramente electrostática, Mn+NO2–, sino de una coordinación Mn+-ONO–.
Los nitritos orgánicos y sus complejos establecerán o no estructuras cristalinas dependiendo si sus interacciones logran fijar sus partículas ordenadamente en el espacio.
Los nitritos inorgánicos y orgánicos comparten una nomenclatura considerablemente simple. Para nombrarlos, se colocan primero las palabras ‘nitrito de’, seguido del nombre del metal y su valencia escrita entre paréntesis. Asimismo, pueden utilizarse las terminaciones –ico y –oso en el caso de que haya más de una valencia.
Por ejemplo, el CuNO2 puede nombrarse de dos maneras: nitrito de cobre (I), o nitrito cuproso.
Esta regla de nomenclatura aplica también para los nitritos orgánicos. Por ejemplo, el CH3ONO se llama nitrito de metilo, pues el CH3 corresponde al grupo R enlazado al oxígeno del NO2.
La nomenclatura puede tornarse complicada si hay otros grupos de igual o mayor relevancia química que el NO2, o si se tratan de complejos metálicos.
Muchos nitritos inorgánicos se forman en la naturaleza en uno de los pasos del ciclo de nitrógeno: la nitrificación. Este proceso consiste de la oxidación del amoníaco realizada por microorganismos, específicamente, por bacterias nitrosomonas.
La nitrificación también abarca la subsecuente oxidación del nitrito a nitrato; sin embargo, la formación del nitrito es el paso lento de estas reacciones, pues requiere mayor energía y debe vencer una mayor barrera cinética.
La siguiente ecuación ejemplifica lo recién expuesto arriba:
2NH4+ + 3O2 → 2NO2– + 4H+ + 2H2O
En esta reacción participan varias enzimas y se produce hidroxilamina, NH2OH, que es el producto del cual se originará finalmente los aniones nitritos.
Es gracias a la nitrificación que las plantas contienen nitritos, y a su vez, los animales que las consumen. Los nitritos no solo están presentes en el suelo, sino también en los mares, y la casi totalidad de su producción natural se debe a la acción oxidativa y anaeróbica de diversos microorganismos.
Los nitritos de los metales alcalinos pueden prepararse industrialmente haciendo burbujear óxidos nitrogenados en soluciones o medios básicos, ya sea de sus respectivos hidróxidos o carbonatos. Por ejemplo, el nitrito de sodio se produce de acuerdo a la siguiente reacción:
NO + NO2 + NaOH → 2NaNO2 + H2O
En el caso del nitrito de amonio, se hace burbujear trióxido de dinitrógeno en amoníaco:
2NH3 + H2O + N2O3 → 2NH4NO2
Los nitritos alquílicos, RONO, pueden sintetizarse haciendo reaccionar alcoholes alquílicos con óxido nítrico, en contacto con el aire y utilizando como medio de reacción solventes orgánicos. La reacción general vendría a ser la siguiente:
R-OH → R-ONO

Los nitritos tienen efectos antibacterianos, por lo que se agregan en moderadas cantidades a la carne para ralentizar su putrefacción. Además de cumplir esta función, reaccionan con las proteínas de la carne para otorgarles una coloración más rojiza y atractiva.
El lado malo de esta práctica es que algunas carnes pueden tener demasiadas sales de nitrito, y al cocinarlas a altas temperaturas, se transforman en nitrosoaminas. Por lo tanto, existe el riesgo de aumentar las probabilidades de contraer algún tipo de cáncer si el consumo de estas carnes curadas es excesivo.
Los nitritos se utilizan en química orgánica para llevar a cabo la reacción de diazotación, con la cual se sintetizan los colorantes o tintes azo.
Algunos complejos de nitrito, como los de cobalto, pueden utilizarse como pigmentos para las pinturas o porcelanas debido a sus llamativas coloraciones.
Los nitritos son responsables de generar óxido nítrico en el organismo en regiones deficientes de oxígeno. El NO es una molécula de señalización, a la que responde los vasos sanguíneos relajándose y expandiéndose. Esta expansión o dilatación tiene como consecuencia que disminuya la presión arterial.
Para finalizar, se enlistarán algunos ejemplos de nitritos con sus respectivas fórmulas y nombres:
-NaNO2: nitrito de sodio
-KNO2: nitrito de potasio
-Mg(NO2)2: nitrito de magnesio
-Ca(NO2)2: nitrito de calcio
-CH3CH2ONO: nitrito de etilo
-NH4NO2: nitrito de amonio
-Zn(NO2)2: nitrito de zinc
-Pb(NO2)2: nitrito de plomo (II) o nitrito plumboso
-Fe(NO2)3: nitrito de hierro (III) o nitrito férrico
-(CH3)2CHCH2CH2ONO: nitrito de isoamilo
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Nitrite. Recuperado de: en.wikipedia.org
- Elsevier B.V. (2020). Nitrite. ScienceDirect. Recuperado de: sciencedirect.com
- Alfa Aesar. (2020). Nitrite Salts. Thermo Fisher Scientific. Recuperado de: alfa.com
- The Editors of Encyclopaedia Britannica. (23 de febrero de 2018). Nitrites. Encyclopædia Britannica. Recuperado de: britannica.com
- Anthony R. Butler & Martin Feelisch. (22 de abril de 2018). Therapeutic Uses of Inorganic Nitrite and Nitrate. doi.org/10.1161/CIRCULATIONAHA.107.753814
- Kris Gunnars. (10 de febrero de 2020). Are Nitrates and Nitrites in Foods Harmful? Recuperado de: healthline.com
