Prolina: características, estructura, funciones, alimentos
La prolina (Pro, P) pertenece a los 22 aminoácidos clasificados como básicos. Es un aminoácido no esencial, ya que puede ser sintetizado por el hombre y otros animales mamíferos.
En 1900, el científico alemán Richard Willstatter fue el primero en extraer y observar la prolina. Sin embargo, fue Emili Fischer, en 1901, quien acuñó el término “prolina” basándose el anillo de pirrolidina del aminoácido; esta investigadora, además, logró explicar detalladamente la síntesis de la prolina a partir de la caseína de la leche.
En proteínas como la caseína, la prolina tiene una función indispensable en los “giros” y plegamientos estructurales. En esta proteína, la prolina se distribuye homogéneamente por toda la estructura y enlaza a la caseína β y a la proteína αs1; además, evita que se formen bucles o plegamientos estructurales defectuosos.
En los análisis bioquímicos empleados corrientemente para determinar la secuencia exacta de aminoácidos que componen a las proteínas, la prolina es uno de los aminoácidos de más difícil detección, ya que el grupo amino secundario de la prolina tiene un comportamiento diferente y no puede ser fácilmente detectado.
El escorbuto es quizá la enfermedad más conocida relacionada con la prolina. Tiene que ver con una deficiencia en la ingesta de vitamina C, que afecta directamente la hidroxilación de la prolina en las fibras de colágeno, lo que causa un debilitamiento sistémico debido a la inestabilidad de las fibras de colágeno que están por todo el cuerpo.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Degradación
- 6 Alimentos ricos en valina
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia
- 9 Referencias
El grupo amino secundario unido al carbono α hace que la tarea de clasificación de la prolina sea un tanto difícil. Sin embargo, en algunos textos este es clasificado junto a los aminoácidos ramificados o con cadenas laterales alifáticas, ya que la cadena lateral o grupo R de la prolina tiene carácter hidrofóbico o alifático.
Una de las características más importantes de la prolina es que en ningún caso puede formar puentes de hidrógeno, lo que la hace ideal para estructurar los giros complejos e intrincados en las estructuras terciarias de las proteínas.
Así como todos los aminoácidos poseen dos isoformas que dependen del átomo de carbono central, la prolina puede encontrarse en la naturaleza como L-prolina o como D-prolina. Sin embargo, forma L-prolina es la más abundante en la naturaleza y es la que forma parte de las estructuras proteicas.
En las proteínas donde se encuentra, la prolina frecuentemente ocupa lugares cercanos a la superficie o a los sitios de pliegue o “giro” de la cadena polipeptídica, puesto que la estructura rígida y cerrada de la prolina hacen que sea difícil una interacción fuerte con otros aminoácidos.
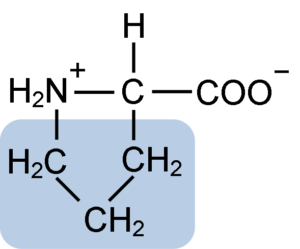
La prolina posee una estructura particular entre los aminoácidos básicos, ya que presenta un grupo amino (NH2) secundario y no el grupo amino primario que es característico de todos los aminoácidos.
El grupo R o la cadena lateral de la prolina es un anillo de pirrolidina o tetrahidropirrol. Este grupo se forma por una amina heterocíclica (sin dobles enlaces) de cinco átomos de carbono, donde cada uno de estos está saturado con átomos de hidrógeno.
La prolina tiene la particularidad de que el átomo de carbono “central” está incluido en el anillo heterocíclico de pirrolidina, por lo que los únicos átomos “libres” o “sobresalientes” son el grupo carboxilo (COOH) y el átomo de hidrógeno (H) del anillo heterocíclico del aminoácido.
La fórmula molecular de la prolina es C5H9NO2 y su nombre IUPAC es ácido pirrolidin-2-carboxílico. Tiene un peso molecular aproximado de 115,13 g/mol y su frecuencia de aparición en las proteínas es aproximadamente del 7%.
Las fibras de colágeno y de tropocolágeno son las proteínas más abundantes en la mayoría de los animales vertebrados. Estas componen la piel, los tendones, la matriz de los huesos, y muchos otros tejidos.
Las fibras de colágeno se componen de muchas hélices triples de repetidos polipeptídicos que, a su vez, están compuestas de múltiples residuos de prolina y glicina en la secuencia glicina-prolina-prolina/hidroxiprolina (este último es un derivado modificado de la prolina).
En su forma nativa, la prolina es parte del procolágeno, siendo este un precursor de los polipéptidos del colágeno y de algunas otras proteínas del tejido conjuntivo. La enzima procolágeno prolina hidroxilasa se encarga de hidroxilar los residuos de prolina para originar la hidroxiprolina y conseguir así la maduración del procolágeno a colágeno propiamente dicho.
La hidroxiprolina le otorga las características de resistencia al colágeno, puesto que este derivado aminoacídico tiene la capacidad de formar gran cantidad de puentes de hidrógeno entre las cadenas de la triple hélice que conforman la proteína.
Las enzimas que catalizan la hidroxilación de los residuos de prolina requieren de la presencia de vitamina C (ácido ascórbico) y, como se mencionó anteriormente, el escorbuto se debe al debilitamiento de las fibras de colágeno por fallas en la hidroxilación de los residuos de prolina, lo que ocasiona una disminución en los puentes de hidrógeno que sostienen las fibras de colágeno.
La prolina es indispensable para la formación de los pliegues y giros de las proteínas.
Su estructura cerrada hace que este aminoácido sea difícil de “acomodar” en el interior de las proteínas, además, dado que no puede formar puentes de hidrógeno para “interactuar” con otros residuos cercanos, induce la formación de “vueltas” o “giros” a lo largo de la estructura de las proteínas donde se encuentra.
Todas las proteínas con un tiempo de vida corto poseen, al menos, una región con abundantes repetidos de prolina, glutamato, serina y treonina. Estas regiones van de 12 a 60 residuos y se les denomina secuencias PEST.
Las proteínas que contienen la secuencia PEST son marcadas por ubiquitinación para su posterior degradación en los proteosomas.
Muchos aminoácidos pueden ser sintetizados a partir de intermediarios de la glucólisis, de la ruta de las pentosas fosfato o del ciclo del ácido cítrico (ciclo de Krebs). La prolina y la arginina se forman en las rutas cortas del glutamato.
La ruta biosintética virtualmente común para todos los organismos vivos comienza con la conversión del L-glutamato en γ-L-glutamil-5-fosfato gracias a la acción de la enzima glutamato-5-quinasa (en bacterias) o por la γ-glutamil-quinasa (en humanos).
Esta reacción implica una fosforilación dependiente de ATP por lo que, además del producto principal, se genera una molécula de ADP.
La reacción catalizada por la glutamato 5-semialdehído deshidrogenasa (en bacterias) o por la γ-glutamil fosfato reductasa (en humanos) convierte el γ-L-glutamil-5-fosfato en L-glutamato-5-semialdehído y dicha reacción amerita la presencia del cofactor NADPH.
El L-glutamato-5-semialdehído es deshidratado reversible y espontáneamente a (S)-1-1-pirrolina-5-carboxilato, que posteriormente es convertido en L-prolina por la enzima pirrolina-5-carboxilato reductasa (en bacterias y humanos), en cuya reacción también es necesaria una molécula de NADPH o NADH.
La prolina, la arginina, la glutamina y la histidina son constantemente degradas a α-cetoglutarato para entrar en el ciclo del ácido cítrico o ciclo de Krebs. En el caso particular de la prolina, esta primero es oxidada por la enzima prolina oxidasa a pirrolin-5-carboxilato.
En el primer paso, donde ocurre la oxidación de la prolina a pirrolin-5-carboxilato, los protones desprendidos son aceptados por el E-FAD, reduciéndose a E-FADH2; este paso es exclusivo para el aminoácido prolina.
Por una reacción espontánea, el pirrolin-5-carboxilato se transforma en glutamato γ-semialdehído, que luego sirve como sustrato para la enzima glutamato γ-semialdehído deshidrogenasa. En este paso se desprenden dos protones, uno de ellos es aceptado por el NAD que se reduce a NADH, y el otro queda libre en forma de H+.
La arginina, al igual que la prolina, se transforma en glutamato γ-semialdehído, pero a través de una ruta metabólica alterna en la que participan dos enzimas diferentes.
La enzima glutamato γ-semialdehído deshidrogenasa transforma el glutamato γ-semialdehído en L-glutamato. Posteriormente, este L-glutamato es oxidado nuevamente por una enzima glutamato deshidrogenasa, con lo que finalmente se forma el α-cetoglutarato que será incorporado en el ciclo del ácido cítrico.
En el paso de oxidación del glutamato se libera un protón (H+) y un grupo amino (NH3+). El protón reduce un grupo NADP+ y se origina una molécula de NADPH.
A pesar de las numerosas semejanzas que existen entre las rutas de degradación y biosíntesis de la prolina y la arginina, estos aminoácidos se sintetizan y se degradan mediante rutas totalmente opuestas que emplean enzimas diferentes, cofactores diferentes y que ocurren compartimientos intracelulares diferentes.
En general, todos los alimentos con un alto contenido proteico poseen grandes cantidades de prolina. Entre estos están la carne, la leche, los huevos y otros. No obstante, cuando nuestro cuerpo se encuentra en un estado óptimo de salud y nutrición es capaz de sintetizar prolina de forma endógena.
La prolina también se puede encontrar en muchas legumbres y frutos secos y en cereales integrales como la avena, por ejemplo. Otros alimentos ricos en prolina son el salvado de trigo, las nueces, las almendras, las arvejas, los frijoles, entre otros.
Algunas tiendas naturistas suelen formular comprimidos de los aminoácidos L-lisina y L-prolina combinados para ayudar a las personas con problemas en las articulaciones o para retrasar el envejecimiento de los tejidos.
No obstante, no se ha demostrado a ciencia cierta que ingerir suplementos dietéticos de estos aminoácidos tenga un efecto significativo en el retraso de la vejez u otras condiciones propias del avance de la edad.
Las dietas ricas en prolina usualmente son prescritas para las personas que presentan enfermedades articulares como la artritis, los esguinces, las roturas de ligamentos, luxaciones, tendinitis y otras, y ello se debe a su relación con la síntesis de las fibras de colágeno presentes en los tejidos conectivos corporales.
Muchas de las lociones y comprimidos farmacológicos empleados en la industria estética están enriquecidos con L-prolina, ya que algunos estudios han demostrado que este aminoácido puede de alguna manera aumentar la síntesis de colágeno y, por lo tanto, mejorar la textura de la piel, acelerar la cicatrización de heridas, de laceraciones, de úlceras y de quemaduras.
En la industria alimenticia existen proteínas que poseen “péptidos bioactivos” que ejercen funciones más allá de sus propiedades nutricionales. Estos péptidos tienen, por lo general, de dos a nueve residuos aminoacídicos entre los que abundan la prolina, la arginina y la lisina.
Dichos péptidos bioactivos pueden tener actividad antihipertensiva con cierto efecto opioide; pueden actuar como inmunomoduladores al estimular la respuesta inmune contra algunos patógenos e incluso pueden ocasionar incrementos en la vasoactividad, lo que mejora la circulación de quienes los consumen.
El gluten es una proteína presente en los granos del trigo que causa la inflamación del intestino. Las personas que padecen de “intolerancia al gluten” se conocen como pacientes “celíacos” y se sabe que esta proteína es rica en prolina y glutamina, cuya degradación proteolítica es dificultosa para las personas con dicha condición.
Algunas enfermedades tienen que ver con el mal plegamiento de proteínas importantes y es muy común que estos defectos tengan que ver con la isomerización cis–trans de los enlaces amida en los residuos de prolina, ya que, a diferencia de otros enlaces peptídicos en los que el isómero trans está muy favorecido, en la prolina se encuentra desfavorecido.
En los residuos de prolina se ha observado que existe una tendencia significativa hacia la formación del isómero cis primero que el isómero trans en las amidas adyacentes a los residuos de prolina, lo que puede generar una conformación “incorrecta” de las proteínas.
Tal y como sucede con otros aminoácidos esenciales y no esenciales, los principales trastornos patológicos relacionados con la prolina tienen que ver, usualmente, con defectos en las rutas de asimilación de este aminoácido.
La hiperprolinemia, por ejemplo, es un caso típico de deficiencia en una de las enzimas que participan en la ruta de degradación de la prolina, concretamente en la 1-pirrolina-5-carboxilato deshidrogenasa, lo que conduce a una acumulación de su sustrato, que finalmente inactiva la ruta.
Esta patología suele diagnosticarse por elevados contenidos de prolina en el plasma sanguíneo y por la presencia del metabolito 1-pirrolina-5-carboxilato en la orina de los pacientes afectados.
Los síntomas principales de esta enfermedad consisten en desórdenes neurológicos, enfermedades renales y pérdida de la capacidad auditiva o sordera. Otros casos más severos incluyen retraso mental severo y marcadas dificultades psicomotoras.
- Abu-Baker, S. (2015). Review of Biochemistry: Concepts and Connections
- Delauney, A. J., & Verma, D. P. S. (1993). Proline biosynthesis and osmoregulation in plants. The plant journal, 4(2), 215-223.
- List, B., Lerner, R. A., & Barbas, C. F. (2000). Proline-catalyzed direct asymmetric aldol reactions. Journal of the American Chemical Society, 122(10), 2395-2396
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
- Plimmer, R. H. A. (1912). The chemical constitution of the proteins (Vol. 1). Longmans, Green.
- Szabados, L., & Savouré, A. (2010). Proline: a multifunctional amino acid. Trends in plant science, 15(2), 89-97.
