Azida de sodio (NaN3): estructura, propiedades, usos, riesgos
La azida de sodio es un sólido inorgánico cristalino formado por el ion sodio Na+ y el ion azida N3–. Su fórmula química es NaN3. El compuesto NaN3 es la sal sódica del ácido hidrazoico HN3. La NaN3 es un sólido cristalino de incoloro a blanco.
Aunque es un compuesto muy tóxico, uno de sus empleos más extendidos ha sido en las bolsas de aire que se inflan de forma instantánea durante accidentes de vehículos. Igualmente sirve para inflar rápidamente los toboganes de emergencia de los aviones. Sin embargo, actualmente su uso está siendo muy cuestionado en ambos casos por su toxicidad.

Se utiliza en los laboratorios de investigación química para sintetizar varios tipos de compuestos y en los laboratorios bioquímicos para estudios con bacterias, hongos o células de mamíferos o humanas.
En algunos laboratorios se usa para esterilizar materiales o equipos, pero ciertos tipos de microorganismos resisten su acción biocida.
También se ha empleado en agricultura para eliminar parásitos del suelo o en la industria maderera para evitar que la madera de pino se manche con hongos.
Índice del artículo
La azida de sodio NaN3 está formada por un catión sodio Na+ y un anión azida N3–.
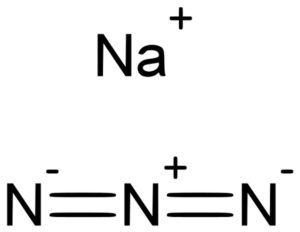
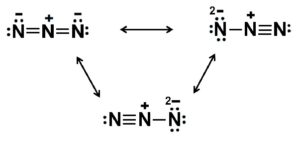
El ion azida N3– está formado por 3 átomos de nitrógeno (N) unidos entre sí por enlaces covalentes que pueden ser sencillos, dobles o triples, pues se comparten los electrones entre los tres.
Dicho anión posee una estructura lineal, es decir, los tres átomos de nitrógeno dispuestos en una línea recta. Además la estructura es simétrica.
– Azida de sodio
– Azida sódica
Sólido cristalino incoloro a blanco. Cristales hexagonales.
65,01 g/mol
Se descompone a 275 ºC.
1,846 g/cm3 a 20 ºC
Es muy soluble en agua: 41,7 g/100 mL a 17 ºC. Es ligeramente soluble en etanol e insoluble en éter etílico.
Tiene un pKb de 9,3. Las soluciones acuosas contienen NH3, el cual escapa rápidamente al ambiente a 37 ºC.
La NaN3 es muy corrosiva hacia el aluminio y de forma moderada hacia el cobre y el plomo.
Según cierta fuente consultada la azida de sodio no es explosiva. Se descompone suavemente y de forma completa al ser calentada a 300 ºC o más, formando metal sodio Na y gas nitrógeno N2.
2 NaN3 → 2 Na + 3 N2↑
Es un agente de nitruración, esto significa que sirve para nitrogenar o añadir nitrógeno a otros compuestos químicos o a la superficie de materiales como el acero.
Es estable en agua neutra o alcalina en ausencia de luz. Se descompone por la radiación solar.
La azida de sodio inhibe una enzima llamada citocromo oxidasa la cual se encuentra en la mitocondria de las células y está involucrada de forma importante en la respiración y generación de energía en esta.
Su acción impide la generación del ATP un compuesto clave en las actividades celulares y la célula se deteriora o daña.
Si se ingiere, inhala o se entra en contacto con la azida de sodio resulta muy tóxica y puede llegar a ser letal.
Se hace reaccionar amoníaco NH3 con metal sodio Na a 350 ºC en un recipiente cerrado de acero, obteniéndose amida de sodio NaNH2.
La amida de sodio NaNH2 se hace reaccionar con monóxido de dinitrógeno N2O a 230 ºC en un reactor de níquel, y así se forma una mezcla de azida de sodio NaN3, hidróxido de sodio NaOH y amoníaco NH3.
2 NaNH2 + N2O → NaN3 + NaOH + NH3
También se puede obtener al hacer reaccionar la amida de sodio con nitrato de sodio NaNO3 a 175 ºC:
3 NaNH2 + NaNO3 → NaN3 + 3 NaOH + NH3
Para purificar la azida se agrega agua a la mezcla, se lavan los cristales de la azida y luego se evapora el agua. El material cristalino que queda es la azida de sodio NaN3 que luego se seca a 110 ºC.
La azida de sodio ha sido muy utilizada en la industria automovilística como generador de nitrógeno para inflar rápidamente las bolsas de aire (del inglés airbags) de seguridad de los volantes de los automóviles y camiones cuando ocurre un impacto.
También se ha empleado en los toboganes inflables que sirven para escapar rápidamente del interior de los aviones que han aterrizado en situaciones de emergencia.
En ambos casos, el mecanismo involucra la acción de una chispa para producir la reacción inmediata entre la azida de sodio y ciertos compuestos, generando gas nitrógeno N2 y óxido de sodio Na2O.
En esta aplicación se requiere la liberación instantánea de un gas frío y no-tóxico, por lo que el nitrógeno es el gas más apropiado.

Sin embargo, este uso está disminuyendo debido a la toxicidad de la azida de sodio y en su lugar se están empleando compuestos menos tóxicos.
Se emplea como retardador en la manufactura de goma para esponjas, para prevenir la coagulación de látex de estireno o de butadieno cuando estos son almacenados en contacto con metales y para descomponer nitritos en presencia de nitratos.
Se ha usado en agricultura: como biocida y fumigante, además es nematicida, esto es, se aplica en suelos para eliminar nematodos, que son parásitos que atacan algunos cultivos.

Ha funcionado también como herbicida y para evitar la putrefacción de las frutas.
Recientemente el NaN3 se ha utilizado en la preparación de semillas de okra o quimbombó para observar su resistencia a condiciones de anegamiento con agua.
Las semillas a las que previamente se aplicó NaN3 generaron plántulas que soportaron mejor las condiciones de inundación que las no tratadas, mejoró la altura de las plantas, incrementó el número de hojas y aumentó la cantidad de raíces aún con el exceso de agua.
Se utiliza como reactivo químico en la síntesis de compuestos orgánicos, por ejemplo para preparar muchas azidas orgánicas, como la azida de tosilo o azidas de grupos alquilo terciarios, que son importantes en síntesis química.
Sirve para preparar ácido hidrazoico (HN3) y sodio puro (Na).
La azida de sodio NaN3 es un intermediario en la manufactura de explosivos, pues se usa para la preparación de azida de plomo Pb(N3)2. Este último es un compuesto que explota al ser golpeado con fuerza, por lo que se emplea en la construcción de dispositivos detonantes.

La azida de sodio se utiliza cuando se requieren equipos de laboratorio estériles, pues es capaz de destruir diferentes tipos de microorganismos.
Es un agente biocida. Sin embargo, algunas fuentes indican que algunos tipos de bacterias son resistentes a su acción.
Esto lo logra bloqueando el sitio de unión del oxígeno en la citocromo oxidasa que es una enzima involucrada en el proceso de producción de energía de algunos microorganismos.
Se emplea en contadores automáticos de sangre, también en la selección diferencial de bacterias y para preservar soluciones de reactivos de laboratorio pues impide el crecimiento de ciertos microorganismos en estas.
La azida de sodio sirve en la industria maderera para evitar el crecimiento de manchas marrones de hongos en la madera de pino.
También se ha utilizado en la industria japonesa de la cerveza para evitar el desarrollo de un hongo que oscurece esa bebida.
La azida de sodio es un compuesto tóxico que inhibe una enzima importante para la respiración y la vida de las células del ser humano y animales. Se ha encontrado que puede afectar gravemente las células del tejido de vasos sanguíneos del cerebro.
Su efecto inmediato luego de ingestión, inhalación o contacto cutáneo es bajar peligrosamente la presión arterial, lo que puede conducir a la muerte. Por ello debe manipularse con mucha precaución.
Hay fuentes de información que llaman la atención acerca de las bolsas de aire de vehículos que se encuentran destrozados en terrenos de desechos.
En tales casos las personas que desconocen el peligro podrían acceder a los depósitos de NaN3, siendo este un compuesto muy tóxico. Además, existe peligro de contaminación con NaN3 de suelos y aguas.
Así mismo, durante los accidentes, colisiones o incendios de vehículos las personas podrían estar expuestas al NaN3 y esto puede ser subestimado o desconocido por el personal médico que atiende la emergencia.
También se ha llamado la atención sobre la exposición del personal de los laboratorios que lo utilizan.
- Vwioko, E.D. et al. (2019). Sodium Azide Priming Enhances Waterlogging Stress Tolerance in Okra (Abelmoschus esculentus). Agronomy 2019, 9, 670. Recuperado de mdpi.com.
- Kho, D.T. et al. (2017). Death of Blood Brain Barrier Endothelial Cells to Sodium Azide and Its Gaseous Products. Biosensors 2017, 7, 41. Recuperado de mdpi.com.
- U.S. National Library of Medicine. (2019). Sodium azide. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Talavera, M. et al. (2019). Nematode Management in the Strawberry Fields of Southern Spain. Agronomy 2019, 9, 252. Recuperado de mdpi.com.
- Okano, T. et al. (1995). Mechanism of cell detachment from temperature-modulated, hydrophilic-hydrophobic polymer surfaces. In The Biomaterials: Silver Jubilee Compendium. Recuperado de sciencedirect.com.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. Volume A22. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Chang, S. and Lamm, S.H. (2003). Human Health Effects of Sodium Azide Exposure: A Literature Review and Analysis. Int J Toxicol 2003, 22(3):175-86. Recuperado de ncbi.nlm.nih.gov.
