Acetato de sodio: estructura, propiedades, síntesis, usos
El acetato de sodio es una sal sódica del ácido acético cuya fórmula molecular es C2H3O2Na. Consiste de un polvo blanco delicuescente, presente esencialmente bajo dos formas: la anhidra y la trihidratada. Ambas son muy solubles en agua, el solvente universal; pero no tan solubles en alcoholes o acetona.
La forma anhidra tiene una densidad, un punto de fusión y ebullición con valores más altos que los presentados por la forma trihidratada del acetato de sodio. Esto se debe a que las moléculas de agua interfieren entre las interacciones de los iones Na+ y CH3COO–.

El acetato de sodio es estable, especialmente si se almacena entre 2 y 8 ºC; pero es susceptible a la acción de los agentes oxidantes fuertes y a los halógenos.
Puede prepararse por la reacción del bicarbonato de sodio con ácido acético. Asimismo, con la reacción del ácido acético con el hidróxido de sodio. Ambas reacciones son sencillas de elaborar y de bajo costo económico; la primera inclusive puede realizarse en el hogar.
Esta sal es un compuesto poco tóxico. Produce una irritación de la piel, sólo después de un contacto frecuente y continuo. Es poco irritante para los ojos pero puede irritar las vías respiratorias. No se tiene información acerca de un efecto dañino de su ingestión.
Tiene numerosos usos y aplicaciones, destacándose su función amortiguadora del pH, junto con el ácido acético. El amortiguador acetato tiene un pKa = 4,7; lo que confiere una alta eficiencia en la regulación del pH en un medio ácido con valores de pH comprendidos entre 3 y 6.
Debido a su baja toxicidad y a sus propiedades, ha sido usado ampliamente para realzar el sabor de los alimentos, así como un agente que suministra protección contra la descomposición de los mismos debido a su acción contra los microbios.
Índice del artículo
- 1 Estructura del acetato de sodio
- 2 Propiedades
- 3 Síntesis
- 4 Usos
- 5 Experimentos para jóvenes
- 6 Toxicidad
- 7 Referencias
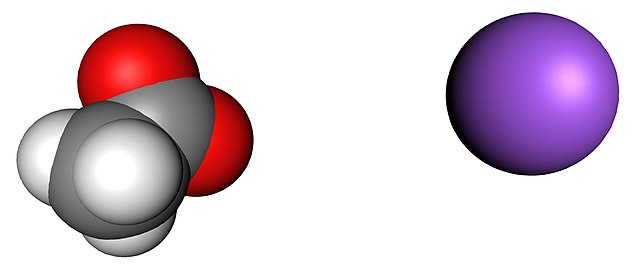
En la imagen superior se muestra los iones que componen los cristales de acetato de sodio anhidro (sin agua). La esfera morada corresponde al catión Na+, y el ion molecular a su izquierda es el acetato, CH3COO–, con sus átomos de oxígeno representados por esferas rojas.
Estos pares, de acuerdo a la fórmula CH3COONa, están en una proporción 1:1; por cada anión CH3COO–, debe haber un catión Na+ atraído por su carga negativa y viceversa. Así, las atracciones entre ellos, y las repulsiones entre cargas iguales, terminan por establecer patrones estructurales que definen un cristal, cuya mínima expresión es la celda unitaria.
Dicha celda unitaria, al igual que el cristal como un todo, varía dependiendo de la disposición de los iones en el espacio; no siempre es la misma, aun para un mismo sistema cristalino. Por ejemplo, el acetato de sodio anhidro puede formar dos polimorfos ortorrómbicos, uno de los cuales se representa abajo:
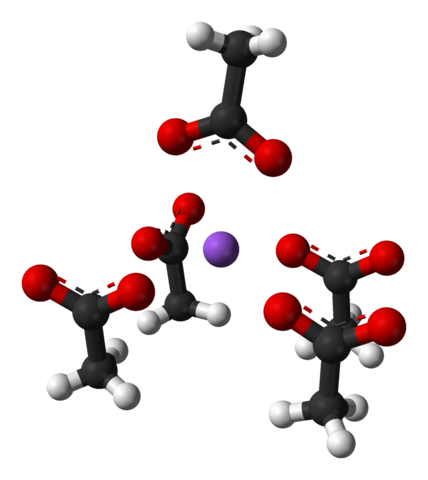
Nótese la disposición de los iones: cuatro iones CH3COO– encierran a un Na+ de tal manera que “dibujan” una pirámide de base cuadrada distorsionada. Cada uno de estos CH3COO– a su vez interaccionan con otro Na+ adyacente.
El acetato de sodio tiene mucha afinidad por el agua; de hecho es delicuescente, es decir, retiene humedad hasta disolverse en la misma. A mayor humedad, más pronto se “derrite”. Esto se debe a que tanto el CH3COO– como el Na+ pueden hidratarse, rodearse de moléculas de agua que orientan sus dipolos hacia sus cargas (Na+ OH2, CH3COO– HOH).
Cuando esta sal se prepara en el laboratorio o en casa, es tal su afinidad por el agua que incluso a temperaturas normales ya se obtiene como hidrato; el CH3COONa·3H2O. Sus cristales dejan de ser ortorrómbicos y se convierten en monoclínicos, ya que en ellos incorporan ahora tres moléculas de agua por cada par CH3COO– y Na+.
-Acetato de sodio.
-Etanoato de sodio (IUPAC).
-Anhidro: 82,03 g/mol.
-Trihidratado: 136,03 g/mol.
Polvo blanco delicuescente.
A vinagre cuando es calentado a descomposición.
-Anhidro: 1, 528 g/cm3 a 20 ºC.
-Trihidratado: 1,45 g/cm3 a 20 ºC.
-Anhidro: 324 ºC (615 ºF, 597 K).
-Trihidratado: 58 ºC (136 ºF, 331 K).
-Anhidro: 881,4 ºC (1.618,5 ºF, 1.154,5 K).
-Trihidratado: 122 ºC (252 ºF, 395 K). Se descompone.
En agua
-Anhidro: 123,3 g/100 mL a 20ºC.
-Trihidratado: 46,4 g/100 mL a 20 ºC.
En metanol
16 g/100 g a 15 ºC.
En etanol
5,3 g/100 mL (trihidratado).
En acetona
0,5 g/kg a 15 ºC.
pKa: 24 (20 ºC).
pKb: 9,25. Aquí se evidencia que el acetato de sodio es una sal básica por tener que pKb menor que su pKa.
1,464
-100,83 J/mol·K (anhidro).
-229,9 J/mol·K (trihidratado).
Superior a los 250ºC.
600 ºC.
8,9 (solución 0,1 M a 25 ºC).
Estable. Incompatible con agentes oxidantes fuertes y halógenos. Sensible a la humedad.
El acetato de sodio puede formar un éster al reaccionar con un haluro de alquilo; por ejemplo, bromoetano:
CH3COONa + BrCH2CH3 => CH3COOCH2CH3 + NaBr
El acetato de sodio se descarboxila para formar metano (pirolisis) en presencia de NaOH:
CH3COONa + NaOH => CH4 + Na2CO3
La reacción es catalizada por sales de cesio.
Se puede producir acetato de sodio a bajo costo en el laboratorio haciendo reaccionar el bicarbonato de sodio con el ácido acético:
NaHCO3 + CH3COOH => CH3COONa + H2CO3
Esta reacción va acompañada por la presencia en la solución de un intenso burbujeo, debido a la descomposición del ácido carbónico en agua y dióxido de carbono.
H2CO3 => H2O + CO2
Industrialmente, el acetato de sodio es producido mediante la reacción de ácido acético con hidróxido de sodio.
CH3COOH + NaOH => CH3COONa + H2O
El acetato de sodio se utiliza para la fabricación de las bolsas térmicas.
Inicialmente, los cristales de la sal son disueltos en un volumen de agua para la preparación de una solución que llega a ser sobresaturada.
Luego se calienta la solución de a una temperatura mayor de 58 ºC, que es su punto de fusión. Se deja enfriar la solución sobresaturada a temperatura ambiente y no se observa la formación de cristales; la solución está sobreenfriada.
La ausencia de cristales se explica en que las moléculas del líquido están demasiados desordenadas y no tienen la orientación debida para alcanzar la temperatura de cristalización. El líquido está en un estado metaestable, un estado de desequilibrio.
Dada la inestabilidad del líquido sobreenfriado, basta cualquier perturbación para iniciar la cristalización. En el caso de las bolsas térmicas, se presiona un aditamento mecánico para agitar el líquido e iniciar la formación de cristales y la solidificación de la solución de acetato de sodio trihidratado.
A medida que ocurre la cristalización, se va incrementando la temperatura. Los cristales de acetato de sodio trihidratado adquieren el aspecto de hielo, pero son calientes, por lo que se le denomina “hielo caliente”.
-El acetato de sodio es utilizado en la industria textil como mordiente en el proceso de tinción de tejidos
-Neutraliza los desechos de ácido sulfúrico
-Tiene uso en el procesamiento del algodón para la elaboración de almohadillas de algodón, utilizables en la limpieza personal y con fines médicos
-Se emplea en el decapado de metales, previo a su cromado
-Colabora para que no ocurra la vulcanización del cloropreno en el proceso de producción de caucho sintético
-Interviene en la purificación de la glucosa
-Se utiliza en el curtido de pieles.
El acetato de sodio forma parte de los compuestos que se utilizan para suministrar los electrolitos administrados a pacientes por vía intravenosa.
Es utilizado para corregir los niveles de sodio en pacientes hiponatrémicos, también en la corrección de la acidosis metabólica y la alcalinización de la orina.
Se usa como regulador de pH en muchísimas reacciones enzimáticas que ocurren entre el pH 3 y el pH 6.
Los diferentes pH de la solución amortiguadora acetato, son alcanzados por la variación de la concentración del ácido acético y del acetato de sodio.
Así por ejemplo, para obtener un pH 4,5 la solución amortiguadora tiene una concentración de ácido acético de 3,8 g/L y una concentración de acetato de sodio anhidro de 3,0 g/L.
Se puede aumentar la concentración de la solución amortiguadora acetato, aumentando en la misma proporción los componentes de la solución necesarios para obtener el pH deseado.
El amortiguador acetato/acetonitrilo se usa en la electroforesis capilar en la separación de fotoberberinas.
-El acetato de sodio es un agente nucleófilo débil que se utiliza en la polimerización aniónica de la β-lactona.
-Se usa como reactivo en la resonancia magnética nuclear de macromoléculas biológicas.
-Se utiliza en la extracción del ADN de las células. El sodio es un catión que interacciona con las cargas negativas de los fosfatos presentes en el ADN, lo que ayuda en su condensación. En la presencia de etanol, el ADN forma un precipitado que puede separarse luego en la capa acuosa.
-Ayuda a prevenir el crecimiento bacteriano, además de impedir la generación de un exceso de acidez que provoque el deterioro de los alimentos, manteniendo así un pH específico.
-El sodio presente en el acetato realza el sabor de los alimentos.
-El acetato de sodio es usado en la preparación de encurtidos de vegetales: pepino, zanahoria, cebolla, etc. Además, se utiliza en la conservación de la carne.
El concreto es dañado por la acción del agua que acorta su tiempo de duración. El acetato de sodio actúa como un agente sellador del concreto que lo impermeabiliza al agua, prolongando sus características iniciales.
Un experimento sencillo es la síntesis de acetato de sodio mediante la reacción de bicarbonato de sodio con vinagre (ácido acético al 5%).
Se colocan 30 mL de vinagre en un vaso de precipitado y se añaden aproximadamente 3,5 g de bicarbonato.
En la reacción se forma acetato de sodio y ácido carbónico. El ácido se descompone en dióxido de carbono y agua. La generación del dióxido de carbono va a producir un burbujeo intenso en el seno de la solución.
Para recoger se el acetato de sodio, se provoca la evaporación del agua, calentando la solución.
Otro experimento sencillo es la formación de cristales del acetato de sodio trihidratado.
Para ello, se pesan alrededor de 20 g de acetato de sodio trihidratado y se coloca en un vaso de precipitado, añadiéndose luego 10 mL de agua. Se calienta la solución a una temperatura superior a 58 ºC.
Se disuelve completamente el acetato de sodio para asegurarse que la solución esté sobresaturada. Previamente, se coloca una cápsula de Pietri sobre una superficie fría.
Se vierte lentamente el contenido del vaso de precipitado con el acetato trihidratado en la cápsula de Pietri. La temperatura del líquido en la cápsula comienza a descender, inclusive bajo el punto de fusión, sin que observe la cristalización o solidificación del acetato de sodio trihidratado.
Usualmente para producir la cristalización del acetato de sodio trihidratado se añade una pequeña cantidad de la sal para que sirva de núcleo de cristalización. Otras veces se produce una pequeña perturbación de la solución, para iniciar la cristalización del acetato de sodio.
Los cristales de acetato de sodio trihidratado tienen el aspecto del hielo, pero si se tocan se notará que están relativamente calientes. Por esta razón, la sal es denominada “hielo caliente”.
El acetato de sodio es un compuesto muy poco tóxico. Tampoco se clasifica como sensibilizante para la piel y las vías respiratorias.
Además, el acetato de sodio no es clasificado como un agente mutagénico en células germinales, carcinógeno o tóxico para la reproducción.
En resumen, es poco irritante para los ojos. Pueden irritarse las vías respiratorias después de su inhalación. El contacto frecuente y constante con la piel puede causar su irritación.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- WorldOfChemicals. (16 de enero de 2017). How to prepare sodium acetate at home? Recuperado de: medium.com
- National Center for Biotechnology Information. (2019). Sodium acetate. PubChem Database. CID=517045. Recuperado de: pubchem.ncbi.nlm.nih.gov
- S. Cameron, K. M. Mannan y M. O. Rahman. (1976). The Crystal Structure of Sodium Acetate Trihydrate. Acta Cryst. B32, 87.
- Wikipedia. (2019). Sodium acetate. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (24 de enero de 2019). Make Hot Ice From Vinegar and Baking Soda. Recuperado de: thoughtco.com
- Chemical Book. (2017). Sodium acetate. Recuperado de: chemicalbook.com
- Wasserman Robin. (2019). Uses of sodium acetate. Recuperado de: livestrong.com
- Drugbank. (2019). Sodium acetate. Recuperado de: drugbank.ca
