Linfocitos B: características, estructura, funciones, tipos
Los linfocitos B, o células B, pertenecen al grupo de leucocitos que participa en el sistema de respuesta inmune humoral. Se caracterizan por la producción de anticuerpos, que reconocen y atacan moléculas específicas para las cuales son diseñadas.
Los linfocitos fueron descubiertos en la década de 1950 y la existencia de dos tipos diferentes (T y B) fue demostrada por David Glick mientras estudiaba el sistema inmune de aves de corral. Sin embargo, la caracterización de las células B se llevó a cabo entre mediados de 1960 y principios de 1970.
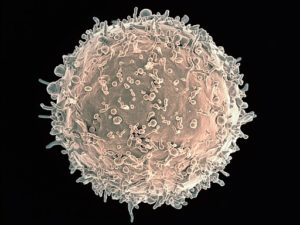
Los anticuerpos producidos por los linfocitos B funcionan como efectores del sistema inmune humoral, ya que participan en la neutralización de los antígenos o facilitan su eliminación por otras células que colaboran con dicho sistema.
Existen cinco clases de anticuerpos principales, que son proteínas sanguíneas conocidas como inmunoglobulinas. No obstante, el anticuerpo más abundante se conoce como IgG y representa más del 70% de las inmunoglobulinas secretadas en el suero.
Índice del artículo
Los linfocitos son células pequeñas, de 8 a 10 micras de diámetro. Tienen grandes núcleos con abundante ADN en forma de heterocromatina. No poseen orgánulos especializados y las mitocondrias, ribosomas y lisosomas están en un pequeño espacio remanente entre la membrana celular y el núcleo.
Las células B, así como los linfocitos T y otras células hematopoyéticas, tienen su origen en la médula ósea. Cuando apenas se han “comprometido” al linaje linfoide, estas aún no expresan receptores de superficie antigénicos, por lo que no pueden responder a ningún antígeno.
La expresión de los receptores membranales ocurre durante la maduración y es entonces cuando son capaces de ser estimulados por antígenos determinados, lo que induce su posterior diferenciación.
Una vez maduras, estas células son liberadas al torrente sanguíneo, donde representan la única población celular con la capacidad de sintetizar y secretar anticuerpos.
No obstante, el reconocimiento de los antígenos, así como la mayor parte de los eventos que ocurren inmediatamente después, no suceden en la circulación, sino en órganos linfoides “secundarios” como el bazo, los nódulos linfáticos, el apéndice, las amígdalas y las placas de Peyer.
Los linfocitos B se originan a partir de un precursor compartido entre las células T, las células asesinas naturales (NK) y algunas células dendríticas. A medida que se van desarrollando, estas células migran hacia diferentes lugares de la médula ósea y su supervivencia depende de factores solubles específicos.
El proceso de diferenciación o desarrollo comienza con el re-arreglo de los genes que codifican para las cadenas pesadas y livianas de los anticuerpos que posteriormente producirán.
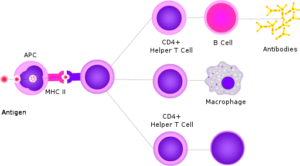
Los linfocitos B tienen una función muy especial en lo que al sistema de defensa se refiere, pues sus funciones son evidentes cuando los receptores en su superficie (anticuerpos) entran en contacto con antígenos provenientes de fuentes “invasoras” o “peligrosas” que son reconocidas como extrañas.
La interacción receptor de membrana-antígeno desencadena una respuesta de activación en los linfocitos B, de manera tal que estas células proliferan y se diferencian en las células efectoras o plasmáticas, capaces de secretar al torrente sanguíneo más anticuerpos como el que reconoció el antígeno que disparó la respuesta.
Los anticuerpos, en el caso de la respuesta inmune humoral, juegan el papel de efectores, y los antígenos que son “etiquetados” o “neutralizados” por estos pueden ser eliminados de distintas formas:
– Los anticuerpos pueden enlazarse con varias moléculas de antígenos, formando agregados que son reconocidos por células fagocíticas.
– Los antígenos presentes en la membrana de un microorganismo invasor pueden ser reconocidos por anticuerpos, lo que activa el llamado “sistema de complemento”. Este sistema consigue la lisis del microorganismo invasor.
– En el caso de los antígenos que son toxinas o partículas virales, los anticuerpos secretados específicamente contra estas moléculas pueden unirse a ellas, recubriéndolas e impidiendo su interacción con otros componentes celulares del hospedador.
Las últimas dos décadas han sido testigo de numerosas investigaciones relacionadas con el sistema inmune y han permitido esclarecer funciones adicionales de las células B. Entre estas funciones están la presentación de antígenos, la producción de citoquinas y una capacidad “supresora” determinada por la secreción de la interleucina IL-10.
Las células B pueden dividirse en dos grupos funcionales: las células B efectoras o células B plasmáticas, y las células B de memoria.
Las células plasmáticas o linfocitos B efectores son las células productoras de anticuerpos que circulan en el plasma sanguíneo. Son capaces de producir y liberar anticuerpos al torrente sanguíneo, pero tienen escaso número de estos receptores antigénicos asociados a sus membranas plasmáticas.
Estas células producen gran cantidad de moléculas de anticuerpo en periodos de tiempo relativamente cortos. Se ha terminado que un linfocito B efector puede producir cientos de miles de anticuerpos por segundo.
Los linfocitos de memoria tienen una vida media superior a la de las células efectoras y, puesto que son clones de una célula B que fue activada por la presencia de un antígeno, expresan los mismos receptores o anticuerpos que la célula que les dio origen.
La activación de los linfocitos B tiene lugar luego de la unión de una molécula de antígeno a las inmunoglobulinas (anticuerpos) unidas a la membrana de las células B.
La interacción antígeno-anticuerpo puede desencadenar dos respuestas: (1) el anticuerpo (receptor membranal) puede emitir señales bioquímicas internas que disparan el proceso de activación del linfocito o (2) el antígeno puede ser internalizado.
La internalización del antígeno en vesículas endosomales conlleva a su procesamiento enzimático (si se trata de un antígeno proteico), donde los péptidos resultantes son “presentados” en la superficie de la célula B con la intención de que sean reconocidos por un linfocito T colaborador.
El linfocitos T colaborador cumple con las funciones de secretar citoquinas solubles que modulan la expresión y la secreción de anticuerpos hacia el torrente sanguíneo.
A diferencia de lo que ocurre en las aves, los linfocitos B de los mamíferos maduran en el interior de la médula ósea, lo que quiere decir que cuando abandonan dicho lugar expresan receptores membranales específicos para la unión de antígenos o anticuerpos membranales.
Durante este proceso, otras células son las responsables de secretar determinados factores que consiguen la diferenciación y maduración de los linfocitos B, como es el caso del interferón gamma (IFN-γ).
Los anticuerpos membranales que están en la superficie de las células B son los que determinan la especificidad antigénica de cada una. Cuando estas maduran en la médula ósea, la especificidad se define por reordenamientos aleatorios de segmentos del gen que codifica la molécula del anticuerpo.
Cuando las células B están completamente maduras, cada una posee solo dos genes funcionales que codifican las cadenas pesadas y livianas de un anticuerpo específico.
En adelante, todos los anticuerpos producidos por una célula madura y su descendencia poseen la misma especificidad antigénica, es decir, están comprometidos en un linaje antigénico (producen el mismo anticuerpo).
En vista de que el reordenamiento genético que sufren los linfocitos B mientras maduran es aleatorio, se estima que cada célula que resulta de este proceso expresa un anticuerpo único, por lo que se generan más de 10 millones de células que expresan anticuerpos para antígenos diferentes.
Durante el proceso de maduración, los linfocitos B que reconocen componentes extracelulares o membranales propios del organismo que los produce son eliminados selectivamente, asegurándose que no se propaguen poblaciones de “auto-anticuerpos”.
Los anticuerpos representan una de las tres clases de moléculas capaces de reconocer antígenos, siendo las otras dos las moléculas receptoras de linfocitos T (TCR, del inglés T Cell Receptors) y las proteínas del complejo mayor de histocompatibilidad (MHC, del inglés Major Histocompatibility Complex).
A diferencia de las TCR y de las MHC, los anticuerpos tienen mayor especificidad antigénica, su afinidad por los antígenos es muy superior y han sido mejor estudiados (gracias a su fácil purificación).
Los anticuerpos pueden estar en la superficie de las células B o en la membrana del retículo endoplásmico. Usualmente se encuentran en el plasma sanguíneo, pero también pueden estar en el líquido intersticial de algunos tejidos.
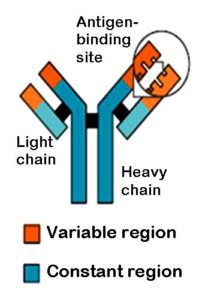
Existen moléculas de anticuerpos de distintas clases, sin embargo, todas son glucoproteínas compuestas por dos cadenas polipeptídicas pesadas y dos livianas que constituyen pares idénticos y que se unen entre sí a través de puentes disulfuro.
Entre las cadenas livianas y pesadas se forma una especie de “hendidura” que corresponde al sitio de unión del anticuerpo con el antígeno. Cada cadena liviana de una inmunoglobulina pesa alrededor de 24 kDa y cada cadena pesada entre 55 o 70 kDa. Las cadenas livianas se unen, cada una, a una cadena pesada y las pesadas también se unen entre sí.
Estructuralmente hablando, un anticuerpo puede dividirse en dos “partes”: una responsable del reconocimiento de los antígenos (región N-terminal) y la otra de las funciones biológicas (región C-terminal). La primera se conoce como región variable, entretanto la segunda es constante.
Algunos autores describen las moléculas de anticuerpos como glicoproteínas con forma de “Y”, gracias a la estructura de la hendidura de contacto con el antígeno que se forma entre las dos cadenas.
Las cadenas livianas de los anticuerpos se designan como “kappa” y “lambda” (κ y λ), pero existen 5 tipos diferentes de cadenas pesadas, que confieren identidad a cada isotipo de anticuerpo.
Se han definido cinco isotipos de inmunoglobulinas, caracterizados por la presencia de las cadenas pesadas γ, μ, α, δ y ε. Estas son, respectivamente IgG, IgM, IgA, IgD y IgE. Tanto las IgG como las IgA pueden, a su vez, subdividirse en otros subtipos llamados IgA1, IgA2, IgG1, IgG2a, IgG2b e IgG3.
Inmunoglobulina G
Este es el anticuerpo más abundante de todos (más del 70% del total) por lo que algunos autores se refieren a este como el único anticuerpo presente en el suero sanguíneo.
Las IgG tienen cadenas pesadas identificadas con la letra “γ” que pesan entre 146 y 165 kDa de peso molecular. Son secretados como monómeros y se encuentran en una concentración desde 0.5 hasta 10 mg/mL.
La vida media de estas células va desde 7 a 23 días y tienen funciones en la neutralización de bacterias y virus, además, median la citotoxicidad dependiente de anticuerpos.
Inmunoglobulina M
La IgM se encuentra como un pentámero, es decir, se encuentra como un complejo formado por cinco porciones proteicas idénticas, cada una con sus dos cadenas livianas y sus dos cadenas pesadas.
Como se mencionó, la cadena pesada de estos anticuerpos se denomina μ; tiene un peso molecular de 970 kDa y se encuentra en el suero a una concentración aproximada de 1.5 mg/mL, con una vida media de entre 5 y 10 días.
Participa en la neutralización de toxinas de origen bacteriano y en la “opsonización” de estos microorganismos.
Inmunoglobulina A
Las IgA son anticuerpos monoméricos y ocasionalmente diméricos. Sus cadenas pesadas se designan con la letra griega “α” y tienen un peso molecular de 160 kDa. Su tiempo de vida media no es superior a los 6 días y se encuentran en el suero a una concentración de 0.5-0.3 mg/mL.
Al igual que las IgM, las IgA tienen la capacidad de neutralizar antígenos bacterianos. También tienen actividad antiviral y se ha determinado que se encuentran como monómeros en los fluidos corporales y como dímeros en las superficies epiteliales.
Inmunoglobulina D
Las IgD también se encuentran como monómeros. Sus cadenas pesadas tienen más o menos 184 kDa de peso molecular y se identifican con la letra griega “δ”. Su concentración en el suero es muy baja (menos de 0.1 mg/mL) y tienen una vida media de 3 días.
Estas inmunoglobulinas pueden encontrarse en la superficie de las células B maduras y envían señales hacia el interior por medio de una “cola” citosólica.
Inmunoglobulina E
Las cadenas pesadas de las IgE se identifican como cadenas “ε” y pesan 188 kDa. Estas proteínas también son monómeros, tienen una vida media de menos de 3 días y su concentración en el suero es casi insignificante (menos de 0.0001).
Las IgE tienen funciones en la unión a mastocitos y basófilos, también median las respuestas alérgicas y las respuestas contra gusanos parasíticos.
- Hoffman, W., Lakkis, F. G., & Chalasani, G. (2015). B Cells, Antibodies, and More. Clinical Journal of the American Society of Nephrology, 11, 1–18.
- Lebien, T. W., & Tedder, T. F. (2009). B Lymphocytes: How They Develop and Function. Blood, 112(5), 1570–1580.
- Mauri, C., & Bosma, A. (2012). Immune Regulatory Function of B Cells. Annu. Rev. Immunol., 30, 221–241.
- Melchers, F., & Andersson, J. (1984). B Cell Activation: Three Steps and Their Variations. Cell, 37, 715–720.
- Tarlinton, D. (2018). B cells still front and centre in immunology. Nature Reviews Immunology, 1–2.
- Walsh, E. R., & Bolland, S. (2014). B Cells: Development, Differentiation, and Regulation by Fcγ Receptor IIB in the Humoral Immune Response. In Antibody Fc: Linking Adaptive and Innate Immunity (pp. 115–129).
