Calor sensible: concepto, fórmulas y ejercicios resueltos
El calor sensible es la energía térmica suministrada a un objeto haciendo que aumente su temperatura. Es lo contrapuesto a calor latente, en el que la energía térmica no aumenta la temperatura sino que promueve un cambio de fase, por ejemplo de sólido a líquido.
Un ejemplo aclara el concepto. Supongamos que tenemos una olla con agua a temperatura ambiente de 20°C. Cuando la colocamos en la hornilla, el calor suministrado aumenta la temperatura del agua lentamente hasta alcanzar los 100 °C (temperatura de ebullición del agua a nivel del mar). El calor suministrado se denomina calor sensible.

Una vez que el agua alcanza la temperatura de ebullición, el calor suministrado por la hornilla ya no eleva más la temperatura del agua, que se mantiene en 100 °C. En este caso la energía térmica suministrada se invierte en evaporar el agua. El calor suministrado es latente porque no elevó la temperatura, sino que provocó un cambio de la fase líquida a la fase gaseosa.
Es un hecho experimental que el calor sensible necesario para lograr cierta variación de temperatura es directamente proporcional a esa variación y a la masa del objeto.
Índice del artículo
Se ha observado que aparte de la masa y la diferencia de temperatura, el calor sensible depende también del material. Por esta razón, la constante de proporcionalidad entre el calor sensible y el producto de la masa por la diferencia de temperatura recibe el nombre de calor específico.
La cantidad de calor sensible suministrada depende también de cómo se lleve a cabo el proceso. Por ejemplo, es diferente si el proceso se lleva a cabo a volumen constante que a presión constante.
La fórmula para el calor sensible en un proceso isobárico, es decir a presión constante, es la siguiente:
Q = cp . m (Tf – Ti)
En la ecuación anterior Q es el calor sensible suministrado al objeto de masa m, que ha elevado su temperatura inicial Ti hasta el valor final Tf. En la ecuación anterior también aparece cp, que es el calor específico del material a presión constante porque el proceso se ha llevado a cabo de esta forma.
Nótese también que el calor sensible es positivo cuando es absorbido por el objeto y causa una elevación de la temperatura.
En el caso que se suministre calor a un gas encerrado en un recipiente rígido, el proceso será isocórico, es decir, a volumen constante; y la fórmula del calor sensible se escribirá así:
Q = cv. m . (Tf – Ti)
El cociente entre el calor específico a presión constante y el calor específico a volumen constante para un mismo material o sustancia recibe el nombre de coeficiente adiabático, el cual generalmente se denota con la letra griega gamma γ.
El coeficiente adiabático es mayor que la unidad. El calor necesario para elevar en un grado la temperatura de un cuerpo de un gramo de masa es mayor en un proceso isobárico que en uno isocórico.
Ello se debe a que en el primer caso parte del calor se utiliza para efectuar trabajo mecánico.
Además del calor específico, se suele definir también la capacidad calorífica de un cuerpo. Esta es la cantidad de calor necesaria para elevar la temperatura de ese cuerpo un grado centígrado.
La capacidad calorífica se denota con C mayúscula, mientras el calor específico con c minúscula. La relación entre ambas cantidades es:
C = c⋅ m
Donde m es la masa del cuerpo.
También se usa el calor específico molar, que se define como la cantidad de calor sensible necesaria para elevar en un grado celsius o kelvin de temperatura a un mol de sustancia.
El calor específico molar de la mayoría de los sólidos tiene un valor cercano a 3 veces R, donde R es la constante universal de los gases. R= 8,314472 J/(mol ℃).
Por ejemplo, el aluminio tiene calor específico molar 24,2 J/(mol ℃), el cobre 24,5 J/(mol ℃), el oro 25,4 J/(mol ℃), y el hierro dulce 25,1 J/(mol ℃). Note que estos valores son cercanos a 3R = 24,9 J/(mol ℃).
En cambio, para la mayoría de los gases el calor específico molar está cerca de n(R/2), donde es n un número entero y R es la constante universal de los gases. El número entero n está relacionado con el número de grados de libertad de la molécula que conforma el gas.
Por ejemplo en un gas ideal monoatómico, cuya molécula solo tiene los tres grados de libertad traslacionales, el calor específico molar a volumen constante es 3(R/2). Pero si es un gas ideal diatómico se tienen adicionalmente dos grados rotacionales, por lo que cv = 5(R/2).
En los gases ideales se cumple la siguiente relación entre el calor específico molar a presión constante y volumen constante: cp = cv + R.
Mención aparte merece el agua. En estado líquido a 25 ℃ el agua tiene cp = 4,1813 J/(g ℃), el vapor de agua a 100 grados centígrados tiene cp = 2,080 J/(g ℃) y el hielo de agua a cero grado celsius tiene cp = 2,050 J/(g ℃).
La materia puede encontrarse en tres estados: sólido, líquido y gaseoso. Para cambiar de estado se requiere energía, pero cada sustancia responde a ella de una manera diferente de acuerdo sus características moleculares y atómicas.
Cuando un sólido se funde o un líquido se está evaporando, la temperatura del objeto permanece constante hasta que todas las partículas han cambiado su estado.
Por eso, es posible que una sustancia se encuentre a la vez en equilibrio en dos fases: sólido – líquido o líquido – vapor, por ejemplo. Una cantidad de la sustancia puede pasar de un estado a otro añadiendo o quitando un poco de calor, mientras la temperatura se mantiene fija.
El calor suministrado a un material hace que sus partículas vibren con mayor rapidez y aumenten su energía cinética. Ello se traduce en una elevación de la temperatura.
Es posible que la energía que adquieren sea tan grande que ya no regresen a su posición de equilibrio y aumente la separación entre ellas. Cuando esto pasa la temperatura no aumenta, sino que la sustancia pasa de sólido a líquido o de líquido a gas.
Al calor necesario para que esto suceda se le conoce como calor latente. Por lo tanto, el calor latente es el calor mediante el cual una sustancia puede cambiar de fase.
Aquí está la diferencia con el calor sensible. Una sustancia que absorbe calor sensible aumenta su temperatura y permanece en el mismo estado.
El calor latente se calcula mediante la ecuación:
Q = m . L
Donde L puede ser el calor específico de vaporización o el de fusión. Las unidades de L son de energía/masa.
Los científicos le han dado numerosas denominaciones al calor, dependiendo del tipo de reacción en que participa. Así por ejemplo está el calor de reacción, el calor de combustión, el calor de solidificación, el calor de solución, el calor de sublimación y muchos otros.
Los valores de muchos de estos tipos de calor para distintas sustancias se encuentran tabulados.
Suponga un que tiene un trozo de aluminio de 3 kg de masa. Inicialmente está a 20 °C y se desea elevar su temperatura hasta 100 °C. Calcule el calor sensible necesario.
Solución
En primer lugar necesitamos conocer el calor específico del aluminio
cp = 0,897 J / ( g °C)
Entonces, la cantidad de calor necesaria para calentar el trozo de aluminio será
Q = cp m (Tf – Ti) = 0,897 * 3000 * (100 – 20) J
Q = 215280 J
Calcule la cantidad de calor necesaria para calentar 1 litro de agua desde 25 °C hasta 100 °C a nivel del mar. Exprese el resultado también en kilocalorías.
Solución
Lo primero que debemos recordar es que 1 litro de agua pesa 1 kg, es decir 1000 gramos.
Q = cp m (Tf – Ti) = 4,1813 J/(g ℃) * 1000 g * (100 ℃ – 25 ℃) = 313597,5 J
La caloría es una unidad de energía que se define como el calor sensible necesario para elevar en un grado celsius un gramo de agua. Por lo tanto, 1 caloría equivale a 4,1813 Joules.
Q = 313597,5 J * (1 cal / 4,1813 J) = 75000 cal = 75 kcal.
Un trozo de material de 360,16 gramos se calienta de 37 ℃ hasta 140 ℃. La energía térmica suministrada es de 1150 calorías.
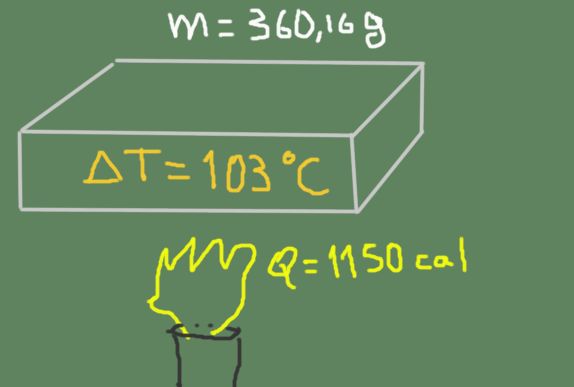
Encuentre el calor específico del material.
Solución
Podemos escribir el calor específico en función del calor sensible, la masa y la variación de la temperatura según la fórmula:
cp = Q /( m ΔT)
Sustituyendo los datos nos queda lo siguiente:
cp = 1150 cal / ( 360,16 g * (140 ℃ – 37 ℃)) = 0.0310 cal / (g ℃)
Pero como una caloría equivale a 4,1813 J, el resultado también puede expresarse como
cp = 0,130 J / (g ℃)
- Giancoli, D. 2006. Physics: Principles with Applications. 6th. Ed. Prentice Hall. 400 – 410.
- Kirkpatrick, L. 2007. Física: Una mirada al mundo. 6ta Edición abreviada. Cengage Learning. 156 – 164.
- Tippens, P. 2011. Física: Conceptos y Aplicaciones. 7ma. Edición revisada. McGraw Hill. 350 – 368.
- Rex, A. 2011. Fundamentos de Física. Pearson. 309 – 332.
- Sears, Zemansky. 2016. University Physics with Modern Physics. 14th. Volume1. 556 – 553.
- Serway, R., Vulle, C. 2011. Fundamentos de Física. 9na Cengage Learning. 362 – 374.
