Nitratos: propiedades, estructura, nomenclatura, formación
Los nitratos son todos aquellos compuestos que contienen el anión NO3–, cuando se trata de sales inorgánicas, o el grupo nitro, -ONO2, en el caso de derivados orgánicos. En inorgánica, todos los nitratos son sales metálicas o del ion amonio, en las cuales predominan las interacciones electrostáticas Mn+NO3–.
Por ejemplo, el nitrato de sodio, NaNO3, está formado por iones Na+ y NO3–. Esta sal, junto con el nitrato de potasio, KNO3, son los ejemplares de nitratos más abundantes en la naturaleza. Los nitratos encuentran en los suelos, en los tejidos vegetales, y sobre todo, en mares y depósitos salinos como los de salitre, ubicados en Chile.
El término ‘nitratos’ alude inmediatamente a sales, fertilizantes y explosivos. Se les relacionan asimismo con las carnes y sus procesos de curado para inhibir el crecimiento de las bacterias y así retrasar sus deterioros. Los nitratos también son sinónimos de vegetales, pues contienen altas cantidades de estas sales.
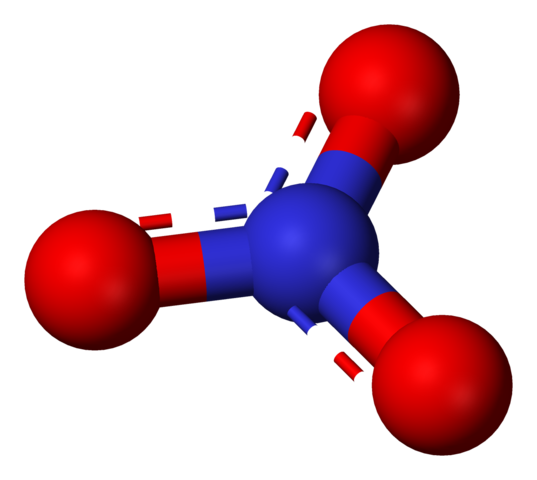
El NO3– (imagen superior) es la forma más oxidada del nitrógeno, siendo el producto final y asimilable de su ciclo biológico. El nitrógeno de la atmósfera sufre varias transformaciones, ya sea por obra de los rayos eléctricos o mediante acciones microbianas, para convertirse en NH4+ y NO3–, ambos solubles en el agua y absorbibles por las plantas.
Los nitratos se utilizan como agentes oxidantes, fertilizantes, explosivos y medicamentos cardiológicos. Este último uso contrasta mucho con los demás, pues se metabolizan o interactúan con el organismo de tal modo que dilatan las venas y arterias; y por lo tanto, se produce un incremento y una mejoría del flujo sanguíneo, aliviando los dolores del corazón.
Índice del artículo
- 1 Propiedades de los nitratos
- 2 Estructura
- 3 Nomenclatura
- 4 Formación
- 5 Aplicaciones
- 6 Ejemplos de nitratos
- 7 Referencias
Los nitratos son en principio sustancias neutras, pues el NO3– es la base conjugada del ácido nítrico, HNO3, un ácido fuerte. En agua, no se hidroliza de modo apreciable:
NO3– + H2O ⇌ HNO3 + OH–
De hecho, se puede decir que esta hidrólisis no ocurre en lo absoluto, siendo despreciables las cantidades de OH–. Por lo tanto, las soluciones acuosas de los nitratos son neutras a menos que haya otras sustancias disueltas.
Los nitratos inorgánicos consisten de sales cuyas fórmulas generales son M(NO3)n, siendo n es la valencia o carga positiva del catión metálico. Todos estos nitratos presentan brillos cristalinos y tienen coloraciones blanquecinas. Sin embargo, los nitratos de los metales de transición pueden ser coloridos.
Por ejemplo, el nitrato de cobre (II) o nitrato cúprico, Cu(NO3)2, es un sólido cristalino azulado. Mientras, el nitrato de níquel (II), Ni(NO3)2, es un sólido color esmeralda. Algunos otros nitratos, como los de hierro, presentan coloraciones tenues.
Por otro lado, los nitratos orgánicos suelen ser líquidos o sólidos altamente sensibles y explosivos.
Los nitratos metálicos son sensibles a las temperaturas altas, ya que comienzan a descomponerse de acuerdo a la siguiente ecuación química:
2M(NO3)2(s)→2MO(s)+4NO2(g)+O2(g)
Tal como se observa, el nitrato metálico se descompone en un óxido, MO, y en dióxido de nitrógeno y oxígeno. Esta descomposición térmica no ocurre a la misma temperatura para todos los nitratos; algunos resisten más que otros.
Como regla general, mientras más grande y menor sea la carga del catión M+, mayor será la temperatura a la que debe calentarse el nitrato para descomponerse. En cambio, cuando M+ es pequeño o tiene una carga positiva grande, el nitrato se descompone a menores temperaturas, siendo por lo tanto más inestable.
Por ejemplo, el nitrato de sodio, NaNO3, se descompone a una temperatura menor que la del nitrato de bario, Ba(NO3)2, pues aunque el Ba2+ tenga mayor carga que Na+, su tamaño es mucho mayor.
El NO3– es un anión relativamente estable. No obstante, su átomo de nitrógeno se encuentra fuertemente oxidado, con un estado de oxidación de +5 (N5+O32-), por lo que está “sediento” de electrones. Por esta razón, el nitrato es un agente oxidante, el cual buscará arrebatar electrones de sustancias a su alrededor.
Es esta carencia de electrones en el átomo de nitrógeno del NO3– lo que hace el NaNO3 y KNO3 agentes oxidantes fuertes, utilizados como componentes de la pólvora. Sumando a esta característica el hecho de que se liberan gases NO2 y O2 al descomponerse, se entiende por qué forma parte de muchos explosivos.
Cuando el nitrato gana electrones o se reduce, puede transformarse en amoníaco, NH3, o en óxido nítrico, NO, dependiendo de los reactivos y de las condiciones.
Todos los nitratos inorgánicos, o lo que es igual, los nitratos metálicos y de amonio, NH4NO3, son compuestos solubles en agua. Esto se debe a que las moléculas de agua tienen una fuerte afinidad por los NO3–, y a que las redes cristalinas de estos nitratos no son muy estables.
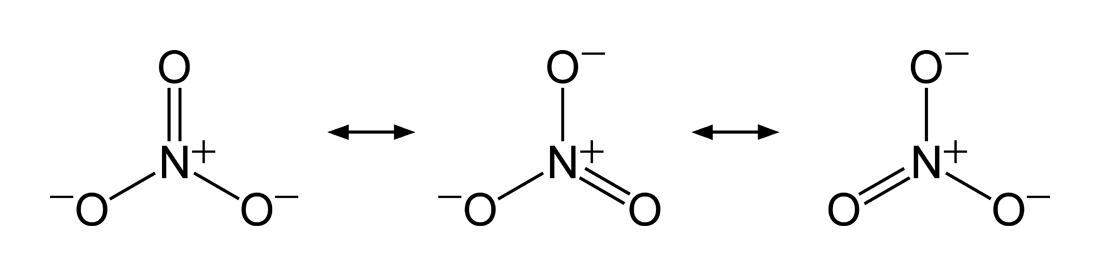
En la imagen superior se muestran las estructuras de resonancia del anión nitrato. Tal como se observa, dos cargas negativas se sitúan en dos átomos oxígeno, las cuales se deslocalizan entre los tres átomos de oxígeno. Por lo tanto, cada O tiene una carga de -2/3, mientras que el nitrógeno tiene una carga de +1.
Así pues, el NO3– interacciona electrostáticamente, o forma enlaces de coordinación, mediante cualquiera de sus tres átomos de oxígeno.
Todos los nitratos inorgánicos son salinos e iónicos. Por lo tanto, sus estructuras son cristalinas, lo que quiere decir que sus iones, M+ y NO3–, se disponen ordenadamente en el espacio gracias a sus interacciones electrostáticas. Dependiendo de estas interacciones, sus cristales presentarán distintas estructuras.
Por ejemplo, la estructura cristalina del NaNO3 es trigonal o romboédrica, mientras que la del KNO3 es ortorrómbica.
Los nitratos orgánicos se representan con la fórmula general RONO2, donde R es un grupo alquílico o aromático. Estos compuestos se caracterizan por su enlace R-ONO2, y suelen consistir de derivados nítricos de polímeros y de otras sustancias orgánicas.
El NO3– se coordina con centros metálicos para formar un enlace M+-ONO2–, siendo una interacción diferente a la iónica. Estos complejos son de naturaleza esencialmente inorgánica. El nitrato puede inclusive coordinarse utilizando dos de sus átomos de oxígeno al mismo tiempo, M+—O2NO.
Para nombrar a un nitrato debe escribirse primero las palabras ‘nitrato de’ seguido del nombre del catión o del grupo R que le acompaña en su respectiva fórmula química. La valencia del catión se especifica entre paréntesis cuando este posea más de una. Asimismo, pueden utilizarse los sufijos –ico y –oso si así se prefiere, siguiendo la nomenclatura tradicional.
Por ejemplo, considérese el Fe(NO3)3. Su nombre es nitrato de hierro (III), debido a que su valencia es +3, o también puede llamarse nitrato férrico.
Estas reglas aplican también para los nitratos orgánicos, siempre que sus estructuras sean simples. Por ejemplo, el CH3ONO2 se llama nitrato de metilo, pues el grupo –CH3 viene a ser el grupo R que acompaña a –ONO2.
Los nitratos se forman en la naturaleza como parte del ciclo biológico del nitrógeno. Debido a esto, los suelos, los mares, y algunas corrientes de agua poseen cantidades significativas de nitratos. Dependiendo de los iones circundantes, se formarán distintas sales de nitratos, siendo NaNO3 y KNO3 las más comunes y abundantes.
Los nitratos se forman a escalas industriales mediante la neutralización del ácido nítrico, ya sea con hidróxidos metálicos, alcoholes, polímeros, etc. Por ejemplo, el nitrato de calcio, Ca(NO3)2, puede prepararse de acuerdo a la siguiente ecuación química:
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
Similarmente, varias sustancias orgánicas son atacadas por el HNO3 bajo ciertas condiciones para promover la sustitución de algunos de sus grupos por –ONO2. Esto es lo que sucede con la reacción de la celulosa para transformarse en nitrocelulosa o nitrato de celulosa, un material polimérico y explosivo.
El anión NO3–, y por lo tanto los nitratos inorgánicos, se pueden formar mediante la acción fotocatalítica de desechos de óxido de titanio, TiO2, utilizando como materia prima nada más que el nitrógeno y el oxígeno del aire. Este estudio supone que donde haya excesos de TiO2, habrá cantidades indeseadas de NO3–, las cuales afectan la potabilidad del agua y pueden, inclusive, plagarlas de algas.

Los nitratos se adicionan a varias carnes, especialmente a los embutidos, para eliminarles las bacterias y retrasar así sus deterioros. Asimismo, reaccionan con las proteínas de las mismas para darles un color más rojizo. El problema de estas carnes es que, al cocinarlas a altas temperaturas, producen nitrosoaminas: compuestos vinculados con el cáncer de colon.
Esta reacción se evita en parte si hay vitaminas presentes, como es el caso de los vegetales, que si bien son ricos en nitratos, no están asociados a patologías cancerígenas.
Los nitratos son una fuente soluble de nitrógeno. Por lo tanto, sirve como fertilizante para aportar nitrógeno a las plantas, y así, favorecer sus crecimientos.
Los nitratos tienen una función especial en el organismo. Al asimilarse por acción enzimática, se reduce a óxido nítrico, NO. Esta molécula ocupa volumen y dilata las venas y arterias, permitiendo que haya mayor flujo de sangre. Por lo tanto, los nitratos se usan como medicamentos para combatir patologías del sistema circulatorio.
Irónica y curiosamente, para este propósito se han utilizado nitratos orgánicos tales como trinitrato de glicerilo, nitroglicerina, mononitrato de isosorbida y tetranitrato de pentaeritritol, todos buenos candidatos en el mundo de los explosivos.
Los nitratos se utilizan en las formulaciones de los explosivos, siendo la pólvora el ejemplo más simbólico. Al ser agentes oxidantes, favorecen la combustión de la materia, además de aportar a la abrupta expansión del volumen por su liberación de gases tras descomponerse.
A lo largo de los apartados anteriores se han mencionado más de un ejemplo de nitratos. Para finalizar, se enlistarán algunos otros juntos con sus respectivas fórmulas y nombres:
-LiNO3: nitrato de litio
-RbNO3: nitrato de rubidio
-Mg(NO3)2: nitrato de magnesio
-Sc(NO3)2: nitrato de escandio
-Cr(NO3)3: nitrato de cromo (III)
-Zn(NO3)2: nitrato de zinc
-Pb(NO3)2: nitrato de plomo (II)
-AgNO3: nitrato de plata
-CH3CH2ONO2: nitrato de etilo
-CH3(CH2)4ONO2: nitrato de amilo
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Clark J. (05 de junio de 2019). The Thermal Stability of the Nitrates and Carbonates. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Wikipedia. (2020). Nitrate. Recuperado de: en.wikipedia.org
- Angela Dowden. (12 de marzo de 2019). The truth about the nitrates in your food. Recuperado de: bbc.com
- Elsevier B.V. (2020). Nitrate. ScienceDirect. Recuperado de: sciencedirect.com
- Dr. Biji S. & Prof. Govindan V. (26 de abril de 2017). The role of organic nitrates in the optimal medical management of angina. European Society of Cardiology. Recuperado de: escardio.org
- Yuan, S., Chen, J., Lin, Z. et al. (2013). Nitrate formation from atmospheric nitrogen and oxygen photocatalysed by nano-sized titanium dioxide. Nat Commun 4, 2249. doi.org/10.1038/ncomms3249
