Trietilamina: estructura, propiedades, usos y riesgos
La trietilamina es un compuesto orgánico, más precisamente una amina alifática, cuya fórmula química es N(CH2CH3)3 o NEt3. Al igual que otras aminas líquidas, presenta un olor parecido al del amoníaco mezclado con pescado; sus vapores hacen tedioso y peligroso manipular esta sustancia sin una campana extractora o indumentaria apropiada.
Además de sus fórmulas respectivas, suele abreviarse a este compuesto como TEA; sin embargo, esto puede ocasionar confusiones con otras aminas, tales como la trietanolamina, N(EtOH)3, o el tetraetilamonio, una amina cuaternaria, NEt4+.
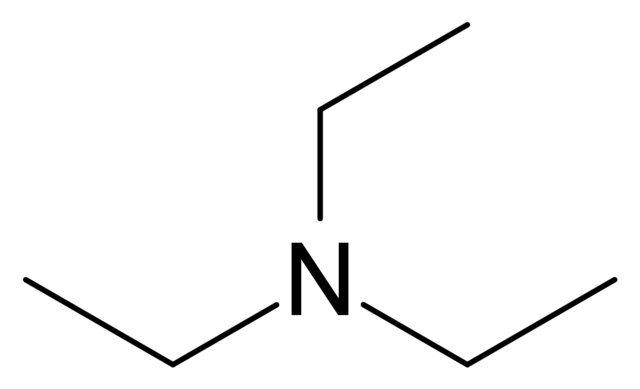
De su esqueleto (imagen superior), se puede decir que la trietilamina se parece bastante al amoníaco; mientras el segundo tiene tres hidrógenos, NH3, el primero tiene tres grupos etilos, N(CH2CH3)3. Su síntesis parte del tratamiento de amoníaco líquido con etanol, ocurriendo una alquilación.
El NEt3 puede formar una sal higroscópica con el HCl: el clorhidrato de trietilamina, NEt3·HCl. Además de esto, participa como catalizador homogéneo en la síntesis de ésteres y amidas, por lo que es un solvente necesario en laboratorios orgánicos.
También, junto a otros reactivos, permite la oxidación de alcoholes primarios y secundarios a aldehídos y cetonas, respectivamente. Al igual que el amoníaco es una base, y por lo tanto, puede formar sales orgánicas mediante reacciones de neutralización.
Índice del artículo
- 1 Estructura de la trietilamina
- 2 Propiedades
- 2.1 Apariencia física
- 2.2 Masa molar
- 2.3 Punto de ebullición
- 2.4 Punto de fusión
- 2.5 Densidad
- 2.6 Solubilidad
- 2.7 Densidad de vapor
- 2.8 Presión de vapor
- 2.9 Constante de Henry
- 2.10 Punto de ignición
- 2.11 Temperatura de autoignición
- 2.12 Capacidad calorífica
- 2.13 Calor de combustión
- 2.14 Calor de vaporización
- 2.15 Tensión superficial
- 2.16 Índice de refracción
- 2.17 Viscosidad
- 2.18 Constante de basicidad
- 2.19 Basicidad
- 3 Usos
- 4 Riesgos
- 5 Referencias

En la imagen superior se muestra la estructura de la trietilamina con un modelo de esferas y barras. En el centro de la molécula se ubica el átomo de nitrógeno, representado por una esfera azulada; y enlazados a él, los tres grupos etilos, como pequeñas ramas de esferas blancas y negras.
Aunque no estén a simple vista, sobre el átomo de nitrógeno hay un par de electrones no compartidos. Estos dos electrones y los tres grupos -CH2CH3 experimentan repulsiones electrónicas; pero por otra parte, contribuyen a definir el momento dipolar de la molécula.
No obstante, tal momento dipolar es inferior al de, por ejemplo, dietilamina, NHEt2; y asimismo, carece de toda posibilidad de formar puentes de hidrógeno.
Esto se debe a que en la trietilamina no hay ningún enlace N-H, y en consecuencia, se observan puntos de fusión y ebullición menores en comparación a otras aminas que sí interaccionan de tal modo.
Si bien existe un momento dipolar leve, no pueden descartarse las fuerzas de dispersión entre los grupos etilos de moléculas de NEt3 vecinas. Sumando este efecto, se justifica por qué, aunque la trietilamina sea volátil, hierve a alrededor de los 89ºC, gracias a su relativamente grande masa molecular.
Líquido incoloro con desagradable olor a amoníaco y pescado.
101,193 g/mol.
89ºC.
-115ºC. Nótese lo débiles que son las fuerzas intermoleculares que unen las moléculas de trietilamina en su sólido.
0,7255 g/mL.
Es relativamente soluble en agua, 5,5 g/100g a 20ºC. Por debajo de los 18,7 ºC, de acuerdo a Pubchem, es incluso miscible con esta.
Además de “llevarse bien” con el agua, también es soluble en acetona, benceno, etanol, éter, y parafina.
3,49 en relación del aire.
57,07 mmHg a 25ºC.
66 μmol/Pa·Kg.
-15ºC.
312ºC.
216,43 kJ/mol.
10.248 cal/g.
34,84 kJ/mol.
20,22 N/m a 25ºC.
1,400 a 20ºC.
0,347 mPa·s a 25ºC.
La trietilamina tiene una pKb igual a 3,25.
La basicidad para esta amina puede expresarse mediante la siguiente ecuación química:
NEt3 + HA => NHEt3+ + A–
Donde HA es una especie ácida débil. El par NHEt3+A– conforma lo que viene a ser una sal de amonio terciario.
El ácido conjugado NHEt3+ es más estable que el amonio, NH4+, debido a que los tres grupos etilos donan parte de su densidad electrónica para disminuir la carga positiva sobre el átomo de nitrógeno; por lo tanto, la trietilamina es más básica que el amoníaco (pero menos básica que el OH–).
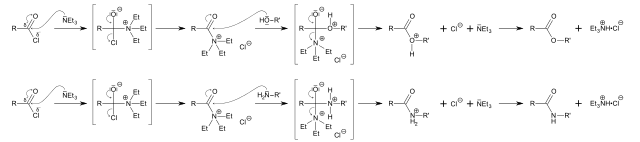
La basicidad, en este caso, la nucleofilicidad de la trietilamina se utiliza para catalizar la síntesis de éster y amidas a partir de un sustrato en común: un cloruro de acilo, RCOCl (imagen superior).
Aquí el par libre de electrones del nitrógeno ataca al grupo carbonilo, formando un intermediario; el cual, consecutivamente, es atacado por un alcohol o una amina para formar un éster o amida, respectivamente.
En la primera fila de la imagen se visualiza el mecanismo que sigue la reacción para producir el éster, mientras que la segunda fila corresponde para la amida. Nótese que en ambas reacciones se produce el clorhidrato de trietilamina, NEt3·HCl, del cual se recupera el catalizador para iniciar otro ciclo.
La nucleofilicidad de la trietilamina también se utiliza para que se añada a ciertos polímeros, curándolos y otorgándoles mayores masas. Por ejemplo, forma parte de la síntesis de resinas policarbonatadas, espumas de poliuretano y resinas epóxidas.
Su remota anfifilicidad y volatilidad permite a sus sales derivadas utilizarse como reactivos en cromatografía de intercambio iónico. Otro uso implícito de la trietilamina es que de ella se puede obtener varias sales de aminas terciarias, como el bicarbonato de trietilamina, NHEt3HCO3 (o TEAB).
Ha sido utilizada como aditivo en la formulación de cigarrillos y tabacos, conservantes de alimentos, limpiadores de pisos, saborizantes, pesticidas, colorantes, etc.
Los vapores de la trietilamina no solo son desagradables sino peligrosos, ya que pueden irritar la nariz, garganta y pulmones hasta provocar edema pulmonar o bronquitis. Asimismo, al ser más densos y pesados que el aire, permanecen a ras del suelo, desplazándose a posibles fuentes de calor para posteriormente explotar.
Los contenedores de este líquido deben estar lo más alejados del fuego porque representan un peligro inminente de explosión.
Además, debe evitarse su contacto con especies o reactivos tales como: metales alcalinos, ácido tricloroacético, nitratos, ácido nítrico (pues formaría nitrosoaminas, compuestos cancerígenos), ácidos fuertes, peróxidos y permanganatos.
No debe tocar el aluminio, cobre, zinc o sus aleaciones, ya que tiene la capacidad de corroerlos.
Referente al contacto físico, puede ocasionar alergia y erupciones en la piel si la exposición es aguda. Además de los pulmones, puede afectar al hígado y los riñones. Y respecto al contacto ocular, causa irritación, la cual incluso podría dañar los ojos si no se tratan o limpian a tiempo.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Wikipedia. (2019). Triethylamine. Recuperado de: en.wikipedia.org
- Merck. (2019). Triethylamine. Recuperado de: sigmaaldrich.com
- National Center for Biotechnology Information. (2019). Triethylamine. PubChem Database. CID=8471. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Toxicology Data Network. (s.f.). Triethylamine. Recuperado de: toxnet.nlm.nih.gov
- New Jersey Department of Health. (2010). Triethylamine. Recuperado de: nj.gov
