Dióxido de cloro (ClO2): estructura, usos, obtención, riesgos, propiedades
El dióxido de cloro es un compuesto inorgánico formado por el elemento cloro (Cl) y el oxígeno (O). Su fórmula química es ClO2. Es un gas color de amarillo verdoso a rojizo. No se encuentra de forma natural en el ambiente.
Es extremadamente reactivo, por lo que es común que se prepare en el sitio donde se va a usar. Uno de sus usos más importantes es como microbicida, antiséptico y desodorizante pues elimina bacterias, virus y hongos con mucha facilidad y en concentraciones muy bajas.

Permite desinfectar alimentos como vegetales, frutas, carnes, aves y mariscos. Sirve para higienizar superficies, pisos, baños, sistemas de ventilación, piscinas, equipos de laboratorio, equipos de dentistas, etc.
Por ello es empleado en el procesamiento de alimentos, en hospitales y clínicas, en industrias y comercios. Se emplea para purificar el agua que sirve para beber y también las aguas residuales municipales.
Es muy efectivo como agente oxidante, por lo que se emplea para blanquear pulpa de papel, aceites, harina, cueros, fibras textiles, entre otros.
Cuando se encuentra en forma de gas es muy peligroso, pues es muy explosivo, y se utiliza principalmente en soluciones acuosas. Es tóxico si se inhala.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Usos como desinfectante
- 6 Otros usos
- 7 Riesgos
- 8 Referencias
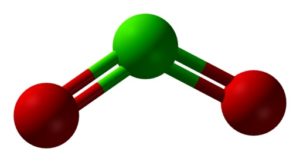
El dióxido de cloro está formado por la unión de un átomo de cloro (Cl) con dos átomos de oxígeno (O). Los enlaces del cloro con cada oxígeno son covalentes y dobles. El cloro en este compuesto posee una valencia de +4.
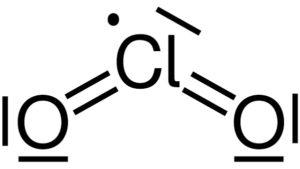
Posee una estructura simétrica y en forma de ángulo, pues posee electrones libres. Esto es, que no forman enlace con ningún otro átomo.
– Dióxido de cloro
– Óxido de cloro (iv)
Gas de color amarillo verdoso a amarillo rojizo.
67,45 g/mol.
-59 ºC.
11 ºC.
Líquido a 0 °C = 1,642 g/cm3
Gas = 2,33 (densidad relativa al aire, aire=1).
Soluble en agua: 2000 cm3 del ClO2 gas en 100 cm3 de agua fría o 0,8 g/100 mL de agua a 20 °C. Soluble en solución alcalina y en solución de ácido sulfúrico H2SO4.
El ClO2 es extremadamente reactivo y puede explotar de forma violenta. Es un agente oxidante muy efectivo.
El ClO2 se descompone violentamente si entra en contacto con materiales orgánicos. Si se encuentra en aire a una concentración mayor al 10% puede explotar por efecto de la luz solar o el calor.
También puede detonar en presencia de mercurio (Hg) o monóxido de carbono (CO).
Bajo la acción de la luz ultravioleta (UV) o del ozono el ClO2 se convierte en hexóxido de cloro Cl2O6, compuesto muy inestable.
Sus soluciones acuosas son amarillas o amarillo rojizas. Son estables si se mantienen frías, bien selladas y protegidas de la luz del sol. En presencia de luz estas soluciones se descomponen lentamente para dar ácido clorhídrico HCl y ácido clórico HClO3.

En las soluciones alcalinas el ClO2 se descompone en iones clorito ClO2- y clorato ClO3-. En las soluciones ácidas se forma ácido cloroso HClO2 y luego este se descompone a ácido clorhídrico HCl y ácido clórico HClO3.
Los vapores concentrados de ClO2 son potencialmente explosivos, por lo que no se ha podido comprimir ni solo ni mezclado con otros gases. Por esta razón se prefiere prepararlo en el sitio donde se va a utilizar.
Cuando se encuentra a muy bajas temperaturas en su forma hidratada, que es la forma en que en ocasiones es trasladado, es un sólido en forma de bloque parecido al hielo y de color naranja.
Posee olor similar al cloro. Es tóxico por inhalación.
Se puede obtener de varias formas. Por ejemplo, en algunos casos las soluciones de ClO2 se preparan haciendo pasar una mezcla de gas cloro (Cl2) y aire (o gas cloro y nitrógeno N2) a través de una columna que contiene gránulos de clorito de sodio (NaClO2).
2 NaClO2 + Cl2 → 2 NaCl + 2 ClO2
El producto generado contiene aproximadamente un 90% de ClO2, entre otros compuestos de cloro.
También se obtiene a partir de clorato de potasio (KClO3) y ácido sulfúrico (H2SO4) en presencia de ácido oxálico como reductor. En este caso se forma también dióxido de carbono (CO2) que sirve para diluir el ClO2.
Se puede preparar en el sitio de uso partiendo de clorato de sodio (NaClO3), ácido sulfúrico (H2SO4) y metanol (CH3OH).
En la industria se obtiene mediante clorato de sodio (NaClO3) y dióxido de azufre (SO2) en presencia de ácido sulfúrico.
2 NaClO3 + SO2 + H2SO4 → 2 ClO2 + 2 NaHSO4
Puede emplearse como un potente agente antimicrobiano. Se ha encontrado que es altamente efectivo contra varios microorganismos, como por ejemplo la Escherichia coli y el Staphylococcus aureus.
Con este último basta una concentración de solo 5 ppm de ClO2 para eliminar el 100% de los mismos. Es bactericida, antiséptico y desodorizante. Es efectivo sobre un amplio intervalo de pH.
Se utiliza como agente antimicrobiano en agua para fumigar frutas y vegetales, en el procesamiento de carnes de aves, carnes rojas, Tanto piezas de carne como órganos, y productos marinos como los mariscos.

Las soluciones de dióxido de cloro deben utilizarse en una concentración que no exceda 3 ppm (partes por millón) de ClO2 residual, de forma que no tenga un efecto sobre los alimentos.
Luego del tratamiento con ClO2 todos los alimentos deben enjuagarse completamente con agua potable, o deben destinarse a escaldado, cocción o enlatado.
En el caso de productos marinos la solución de ClO2 debe emplearse en el agua y hielo que se usan en el enjuagado, lavado, descongelamiento, transporte o almacenaje. Los mariscos crudos deben luego lavarse muy bien con agua potable antes del consumo.

Las soluciones de ClO2 se utilizan para eliminar microrganismos que causan limo (como algas, bacterias y hongos) en el agua de proceso que se emplea en la manufactura de papel y cartón que entrará en contacto con alimentos.
Sirve para purificar agua y hacerla potable (segura para beber). Se utiliza en el pretratamiento de agua que luego será embotellada para beber o agua que será utilizada como ingrediente en la manufactura de bebidas o refrescos.

Se emplea en los instrumentos utilizados por el médico odontólogo o dentista para desinfectarlos y destruir organismos patógenos en los mismos.
Las soluciones acuosas de ClO2 se han empleado para tratar candidiasis orales (infección en la boca). La candidiasis es una infección por el hongo Candida albicans.
El dióxido de cloro elimina el hongo de la boca y mejora significativamente la apariencia de los tejidos bucales sin efectos secundarios.
Algunos investigadores médicos indican que las soluciones de ClO2 aplicadas a heridas de operaciones quirúrgicas pueden disminuir o suprimir la formación de adhesiones sin afectar la curación de la misma, con la ventaja adicional de sus propiedades antisépticas.
Por sus propiedades oxidantes y microbicidas el ClO2 se utiliza para:
– Blanquear la celulosa de la madera en la manufactura de pulpa y papel, proporcionando un brillo estable.
– Decolorar grasas y aceites, cuero, blanquear harina y textiles.
– Aplicaciones agrícolas como desinfectar superficies duras, equipos, sistemas de agua e invernaderos de setas.
– Aplicaciones en industrias, comercios y hospitales como desinfectar superficies duras (paredes, pisos, baños), sistemas de ventilación, equipos de laboratorio.
– Desinfectar pisos y baños de hogares, sistemas de aire acondicionado, sistemas de circulación de agua de piscinas.
– El tratamiento de aguas residuales municipales e industriales.
– Limpieza de contaminación de campos petroleros.
– Manufactura de sales de cloruro (Cl–).
– Los vapores concentrados de ClO2 son potencialmente explosivos.
– Es tóxico por inhalación e ingestión. Es irritante de los ojos, nariz y garganta, puede causar edema pulmonar y bronquitis crónica.
– Según las fuentes consultadas el ClO2 no causa mutaciones en el ADN ni causa cáncer en humanos.
- U.S. National Library of Medicine. (2019). Chlorine dioxide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Dean, J.A. (editor). (1973). Lange’s Handbook of Chemistry (Eleventh Edition). McGraw-Hill Book Company.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Bajpai, P. (2012). Chlorine Dioxide Bleaching. Effect of Chlorine Dioxide Bleaching on Pulp Quality. In Environmentally Benign Approaches for Pulp Bleaching (Second Edition). Recuperado de sciencedirect.com.
- Moran, S. (2018). Water chemistry. Chlorine dioxide. In An Applied Guide to Water and Effluent Treatment Plant Design. Recuperado de sciencedirect.com.
- McKeen, L. (2012). Introduction to Food Irradiation and Medical Sterilization. Gaseous Chlorine Dioxide. In The Effect of Sterilization on Plastics and Elastomers (Third Edition). Recuperado de sciencedirect.com.
