Soluciones químicas: concepto, características, tipos, ejemplos

¿Qué son las soluciones químicas?
Las soluciones químicas son mezclas homogéneas entre un solvente y uno o más solutos. Las soluciones más simples están formadas por un solo soluto y un solvente, como cuando disolvemos azúcar en agua, pero existen soluciones que pueden llegar a ser muy complejas con cientos de solutos.
La mayor parte de las soluciones comunes se encuentran en estado líquido, y en la mayoría de estos casos el solvente es el agua. Por esta razón, al agua se le suele llamar “el solvente universal”. Pero las soluciones no están limitadas a líquidos, ya que existen soluciones en estado gaseoso y en estado sólido.
El soluto también puede encontrarse en diferentes estados. Por ejemplo, se pueden tener soluciones líquidas con solutos sólidos (como la sal), líquidos (como el alcohol) o gaseosos (como el gas carbónico en las bebidas gaseosas).
¿Cómo reconocer el soluto y el solvente?
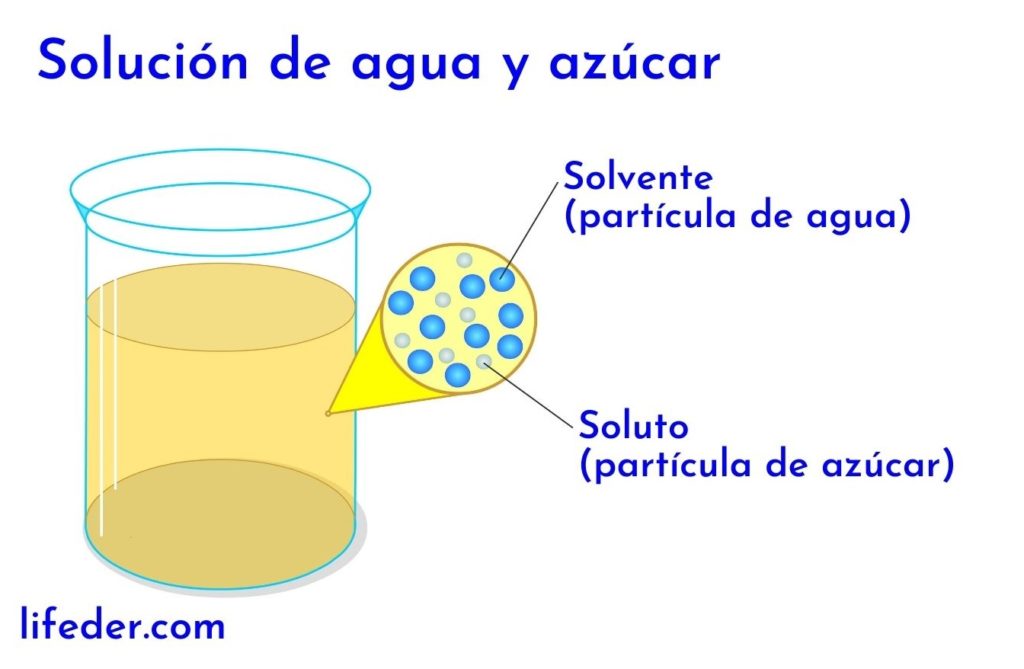
En cualquier solución en la que haya agua, esta se considera que es el solvente. En todos los demás casos, el solvente corresponde al componente que se encuentre en mayor cantidad o en mayor proporción y casi siempre es un líquido. Los demás componentes presentes en la solución se consideran solutos.
Veamos dos ejemplos:
- En una solución de agua y azúcar, el agua es el solvente y el azúcar el soluto.
- El alcohol isopropílico que compramos en la farmacia es una solución formada por agua y alcohol. En esta solución el solvente es el agua a pesar de estar en menor proporción que el alcohol.
Características y propiedades de las soluciones químicas
Son mezclas homogéneas
Las soluciones son mezclas en las que no se puede distinguir al soluto del solvente, ni a simple vista ni con el uso de una lupa o un microscopio.
Tienen composición uniforme
Esto quiere decir que cualquier porción de una solución siempre tendrá los mismos componentes (soluto y solvente) a la misma concentración.
Se caracterizan por su concentración
La concentración es una de las características más importantes de una solución, ya que determina muchas de sus propiedades.
Son translúcidas (transparentes)
Las soluciones líquidas deben ser translúcidas, es decir que la luz debe ser capaz de atravesarlas sin dispersarse.
Son estables
Una solución en la que el soluto y el solvente no reaccionan entre sí será estable indefinidamente. Esto quiere decir que no sufrirá ningún cambio a lo largo del tiempo, siempre y cuando su composición se mantenga constante (no se evapore el solvente, por ejemplo).
Sus propiedades físicas y químicas son distintas a las del solvente
Las propiedades físicas y químicas del solvente cambian al mezclarse con el soluto. Por ejemplo, las soluciones tienen un mayor punto de ebullición, un menor punto de fusión y además tienen una alta presión osmótica en comparación con el solvente puro.
Se pueden separar por medio de algunos procesos físicos y químicos
Las soluciones no se pueden separar por filtración, centrifugación o decantación. Solo se pueden separar por métodos físicos o químicos como la cristalización, la destilación, la evaporación, la ósmosis inversa y la cromatografía, entre otras.
Tipos de soluciones químicas
Las soluciones químicas se pueden clasificar según su concentración, según su estado físico y según la naturaleza del solvente:
Según su concentración
- Soluciones insaturadas: son aquellas en las que el soluto aún no ha alcanzado su máxima concentración en el solvente. Debido a esto, aún se puede disolver más soluto para preparar una solución más concentrada.
- Soluciones saturadas: son soluciones en las que el solvente ya no puede disolver más soluto. En estos casos siempre queda una parte del soluto sin disolver. Por ejemplo, si agregamos mucha sal a un vaso con agua, parte de esta sal no se disolverá y quedará en el fondo del vaso.
- Soluciones sobresaturadas: son soluciones en las que hay más soluto disuelto del que admite el solvente. Esto se puede lograr calentando una solución saturada para disolver aún más soluto, y luego dejando enfriar lentamente hasta la temperatura inicial. Estas soluciones son inestables, ya que cualquier perturbación como una vibración o una pequeña partícula de polvo en la superficie puede causar la separación del exceso de soluto.
Según su estado físico
- Soluciones líquidas: son las más comunes. En este tipo de soluciones el solvente es un líquido (como agua, alcohol, aceite, etc.) pero el soluto puede encontrarse en cualquier estado (sólido, líquido o gas). Algunos ejemplos de soluciones líquidas son el agua salada, el vino y las bebidas gaseosas.
- Soluciones sólidas: en estos casos, tanto el solvente como el soluto se encuentran en estado sólido. Los ejemplos más comunes de este tipo de soluciones son las aleaciones metálicas como el bronce, el acero y el latón, pero también existen otros ejemplos como el vidrio.
- Soluciones gaseosas: como su nombre lo indica, son mezclas homogéneas en las que todos los componentes se encuentran en estado gaseoso.
Según el solvente
- Soluciones acuosas: si en una solución el solvente es el agua, entonces se dice que es una solución acuosa. Estas son las soluciones más comunes que se pueden encontrar en la vida diaria.
- Soluciones alcohólicas: el solvente más común, luego del agua, es el alcohol. Entre los alcoholes más comunes se encuentran el metanol, el etanol y el alcohol isopropílico.
- Soluciones en otros solventes orgánicos: existen muchos otros compuestos orgánicos que se utilizan como solventes. Estos incluyen algunos alcanos, la mayoría de los éteres, las cetonas líquidas y otros.
Ejemplos de soluciones químicas
Limonada
Es una solución acuosa formada por agua como solvente y jugo de limón y azúcar como solutos.
Agua de mar
El agua de mar o agua salada es una solución acuosa compuesta por agua y una mezcla de sales. Entre estas sales, la que se encuentra en mayor proporción es el cloruro de sodio (NaCl) conocida como sal común de mesa.
Almíbar concentrado
Esta es una solución acuosa casi saturada de agua con azúcar.
Agua carbonatada
El agua carbonatada, también conocida como soda, es una solución acuosa de dióxido de carbono gaseoso (CO2) en agua.
Aire
El aire es una solución gaseosa en la que se puede considerar al nitrógeno como solvente y al oxígeno y los demás gases como solutos.
Mantequilla clarificada
Al derretir la mantequilla y remover toda la espuma, se obtiene una solución transparente de color amarillo llamada mantequilla clarificada. Esta es una solución en la que tanto el solvente como los solutos son grasas.
Vidrios de colores
Los vidrios de colores son soluciones en estado sólido, en las cuales el solvente es sílice fundido y los solutos son otros minerales que le proporcionan al vidrio su color característico.
Café
Esta es una solución acuosa compleja que contiene muchísimos solutos (entre ellos la cafeína) que le dan a la bebida su aroma y sabor característicos.
El acero
El acero es una aleación o solución sólida formada por hierro metálico y carbono grafito.
El plasma sanguíneo
El plasma sanguíneo es una solución que se obtiene luego de centrifugar la sangre para retirar todas las células y demás sólidos suspendidos. Esta es una solución acuosa bastante concentrada que contiene cientos de solutos incluyendo carbohidratos, aminoácidos, proteínas solubles y electrolitos, entre otros.
Referencias
- Chang, R. and Goldsby, K. (2014). Chemistry. 11th ed. New York: McGraw-Hill Education.
- Solution (25 January, 2021). En Wikipedia.org.
- Brown, T. L., LeMay, E. (2018). Chemistry: The Central Science. 14va Edición. Pearson.
- Krestonosich, S., y otros. (1992). Disoluciones. Editorial Miró.
- Vidal, J. A. (Editor) (1997). Mentor Interactivo – Enciclopedia Temática Estudiantil. Editorial Océano. Barcelona.
