Glicosilación de proteínas: tipos, proceso y funciones
La glicosilación de proteínas es una modificación postraduccional que consiste en la adición de cadenas de oligosacáridos lineales o ramificados a una proteína. Las glicoproteínas resultantes son generalmente proteínas de superficie y proteínas de la vía secretora.
La glicosilación es una de las modificaciones peptídicas más comunes entre los organismos eucariotas, pero se ha demostrado que también tiene lugar en algunas especies de arqueas y bacterias.
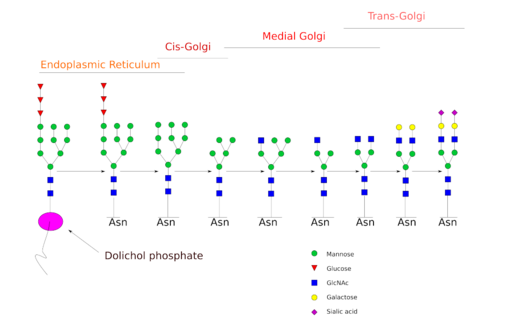
En los eucariotas este mecanismo ocurre entre el retículo endoplasmático (ER) y el complejo de Golgi, con la intervención de diferentes enzimas implicadas tanto en los procesos regulatorios como en la formación de los enlaces covalentes proteína + oligosacárido.
Índice del artículo
Dependiendo del sitio de unión del oligosacárido a la proteína la glicosilación puede clasificarse en 4 tipos:
Es la más común de todas y ocurre cuando los oligosacáridos se unen al nitrógeno del grupo amida de residuos de asparagina en el motivo Asn-X-Ser/Thr, donde X puede ser cualquier aminoácido excepto prolina.
Cuando los carbohidratos se unen al grupo hidroxilo de la serina, treonina, hidroxilisina o tirosina. Es una modificación menos común y son ejemplos proteínas como el colágeno, la glicoforina y las mucinas.
Consiste en la adición de un residuo de manosa que se une a la proteína por un enlace C-C con el C2 del grupo indol en residuos de triptófano.
Un polisacárido actúa como puente para unir una proteína a un ancla de glicosilfosfatidilinositol (GPI) en la membrana.
La N-glicosilación es la que ha sido estudiada con más detalle. En las células de mamíferos el proceso comienza en el ER rugoso, donde un polisacárido preformado se une a las proteínas a medida que estas van emergiendo de los ribosomas.
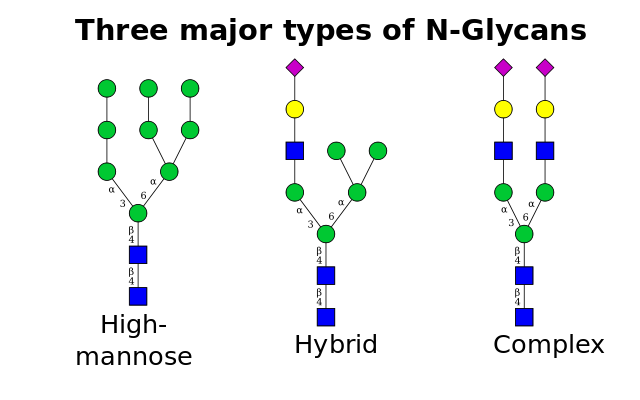
Dicho polisacárido precursor está compuesto por 14 residuos de azúcares, a saber: 3 residuos de glucosa (Glc), 9 de manosa (Man) y 2 de N-acetil glucosamina (GlcNAc).
Este precursor es común en plantas, animales y organismos eucariotas unicelulares. El mismo está unido a la membrana gracias a un enlace con una molécula de dolicol, un lípido isoprenoide embebido en la membrana del ER.
Tras su síntesis, el oligosacárido es transferido por el complejo enzimático oligosacariltransferasa a un residuo de asparagina incluido en la secuencia tri peptídica Asn-X-Ser/Thr de una proteína mientras esta se va traduciendo.
Los tres residuos de Glc en el extremo del oligosacárido sirven como señal de la correcta síntesis de este, y son escindidos junto a uno de los residuos de Man antes de que la proteína sea llevada hacia el aparato de Golgi para procesamiento adicional.
Una vez en el aparato de Golgi, las porciones de oligosacáridos unidos a las glicoproteínas pueden ser modificadas por la adición de residuos de galactosa, ácido siálico, fucosa y muchos otros, lo que rinde cadenas de mucha mayor variedad y complejidad.
La maquinaria enzimática que se necesita para llevar a cabo los procesos de glicosilación incluye numerosas glicosiltransferasas para la adición de los azúcares, glicosidasas para su remoción, y diferentes transportadores de azúcares nucleótidos para el aporte de los residuos empleados como sustratos.
Las bacterias no poseen sistemas de membranas intracelulares, por lo que la formación del oligosacárido inicial (de solo 7 residuos) ocurre en el lado citosólico de la membrana plasmática.
Dicho precursor es sintetizado sobre un lípido que luego es translocado por una flipasa dependiente de ATP hacia el espacio periplásmico, donde ocurre la glicosilación.
Otra diferencia importante entre la glicosilación de eucariotas y procariotas es que la enzima transferasa de oligosacáridos (oligosacariltransferasa) de bacterias puede transferir los residuos de azúcares a porciones libres de proteínas ya plegadas, no a medida que estas son traducidas por los ribosomas.
Además, el motivo peptídico que reconoce esta enzima no es la misma secuencia tri peptídica eucariota.
Los N-oligosacáridos unidos a las glicoproteínas sirven diversos propósitos. Por ejemplo, algunas proteínas requieren de esta modificación postraduccional para conseguir el plegamiento adecuado de su estructura.
A otras les provee estabilidad, bien sea por evitar la degradación proteolítica o porque esta porción les es necesaria para cumplir su función biológica.
Ya que los oligosacáridos poseen un fuerte carácter hidrofílico, su adición covalente a una proteína modifica necesariamente su polaridad y solubilidad, lo que puede tener relevancia desde el punto de vista funcional.
Una vez adheridos a proteínas membranales, los oligosacáridos son valiosos portadores de información. Participan en los procesos de señalización, comunicación, reconocimiento, migración y adhesión celular.
Tienen un importante papel en la coagulación sanguínea, cicatrización y respuesta inmune, así como también en el procesamiento de control de calidad de proteínas, que es dependiente de glicanos e indispensable para la célula.
Al menos 18 enfermedades genéticas han sido relacionadas con la glicosilación de proteínas en humanos, algunas de las cuales implican un pobre desarrollo físico y mental, mientras que otras pueden ser mortales.
Existe un número creciente de descubrimientos relacionados con enfermedades de glicosilación, especialmente en pacientes pediátricos. Muchos de estos desórdenes son congénitos y tienen que ver con defectos asociados a las etapas iniciales de formación de los oligosacáridos o con la regulación de las enzimas que participan en estos procesos.
Puesto que gran parte de las proteínas glicosiladas conforman el glicocálix, existe un interés cada vez mayor en comprobar que mutaciones o alteraciones en los procesos de glicosilación puedan guardar relación con el cambio del microambiente de las células tumorales y con ello, promover a la progresión de tumores y desarrollo de metástasis en pacientes con cáncer.
- Aebi, M. (2013). N-linked protein glycosylation in the ER. Biochimica et Biophysica Acta, 1833(11), 2430–2437.
- Dennis, J. W., Granovsky, M., & Warren, C. E. (1999). Protein glycosylation in development and disease. BioEssays, 21(5), 412–421.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H., … Martin, K. (2003). Molecular Cell Biology (5th ed.). Freeman, W. H. & Company.
- Luckey, M. (2008). Membrane structural biology: with biochemical and biophysical foundations. Cambridge University Press. Retrieved from www.cambrudge.org/9780521856553
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principios de Bioquímica. Ediciones Omega (5th ed.).
- Nothaft, H., & Szymanski, C. M. (2010). Protein glycosylation in bacteria: Sweeter than ever. Nature Reviews Microbiology, 8(11), 765–778.
- Ohtsubo, K., & Marth, J. D. (2006). Glycosylation in Cellular Mechanisms of Health and Disease. Cell, 126(5), 855–867.
- Spiro, R. G. (2002). Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds. Glycobiology, 12(4), 43R–53R.
- Stowell, S. R., Ju, T., & Cummings, R. D. (2015). Protein Glycosylation in Cancer. Annual Review of Pathology: Mechanisms of Disease, 10(1), 473–510.
- Strasser, R. (2016). Plant protein glycosylation. Glycobiology, 26(9), 926–939.
- Xu, C., & Ng, D. T. W. (2015). Glycosylation-directed quality control of protein folding. Nature Reviews Molecular Cell Biology, 16(12), 742–752.
- Zhang, X., & Wang, Y. (2016). Glycosylation Quality Control by the Golgi Structure. Journal of Molecular Biology, 428(16), 3183–3193.
