Rubidio: historia, propiedades, estructura, obtención, usos
El rubidio es un elemento metálico que pertenece al grupo 1 de la tabla periódica: el de los metales alcalinos, siendo representado por el símbolo químico Rb. Su nombre suena parecido al rubí, y se debe a que cuando fue descubierto su espectro de emisión mostró líneas características de color rojo intenso.
Es uno de los metales más reactivos que existen. Es el primero de los metales alcalinos que, a pesar de ser poco densos, se hunde en el agua. Asimismo, reacciona con ella de manera más explosiva en comparación con el litio, sodio y potasio. Ha habido experimentos en el que revientan las ampollas donde es almacenado (imagen inferior) para caer y explotar en bañeras.

El rubidio se distingue por ser un metal más costoso que el mismo oro; no tanto por su escasez, sino por su amplia distribución mineralógica en la corteza terrestre y las dificultades que se plantean al momento de aislarlo de los compuestos de potasio y cesio.
Muestra una clara tendencia a asociarse con el potasio en sus minerales, hallándose como impurezas. No solo en materia geoquímica forma un dúo con el potasio, sino también en el campo de la bioquímica.
El organismo “confunde” los iones K+ por los de Rb+; sin embargo, el rubidio no es un elemento esencial hasta la fecha, pues se desconoce qué rol juega en el metabolismo. Aun así, se ha utilizado suplementos de rubidio para paliar ciertas condiciones médicas como la depresión y la epilepsia. Por otro lado, ambos iones despiden una llama violeta al calor del mechero.
Debido a su alto costo, sus aplicaciones no se hallan asentadas demasiado en la síntesis de catalizadores o materiales, sino como un componente para diversos dispositivos con bases teóricas físicas. Uno de ellos es el reloj atómico, celdas solares y magnetómetros. Es por eso que a veces se tiene al rubidio como un metal subestimado o poco estudiado.
Índice del artículo
- 1 Historia
- 2 Propiedades físicas y químicas
- 2.1 Apariencia
- 2.2 Número atómico (Z)
- 2.3 Masa molar
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Densidad
- 2.7 Calor de fusión
- 2.8 Calor de vaporización
- 2.9 Electronegatividad
- 2.10 Afinidad electrónica
- 2.11 Energías de ionización
- 2.12 Radio atómico
- 2.13 Conductividad térmica
- 2.14 Resistividad eléctrica
- 2.15 Dureza de Mohs
- 2.16 Reactividad
- 3 Estructura y configuración electrónica
- 4 Dónde se encuentra y obtención
- 5 Isótopos
- 6 Riesgos
- 7 Usos
- 8 Referencias
El rubidio fue descubierto en 1861 por los químicos alemanes Robert Bunsen y Gustav Kirchhoff, empleando la espectroscopia. Para ello, utilizaron el mechero Bunsen y el espectroscopio, inventado dos años antes, además de técnicas analíticas de precipitación. Su objeto de estudio fue el mineral lepidolita, cuya muestra la recolectaron de Sajonia, Alemania.
Partieron de 150 kg de mineral lepidolita, la cual trataron con ácido cloroplatínico, H2PtCl6, para precipitar el hexacloroplatinato de potasio, K2PtCl6. Sin embargo, cuando estudiaron su espectro quemándolo en el mechero Bunsen, se dieron cuenta que exhibía líneas de emisión que no coincidían para entonces con ningún otro elemento.
El espectro de emisión de este nuevo elemento se caracteriza por tener dos líneas bien definidas en la región roja. Es por eso que lo bautizaron con el nombre ‘rubidus’ el cual significa ‘rojo oscuro’. Luego, Bunsen y Kirchhoff lograron separar el Rb2PtCl6 del K2PtCl6 mediante cristalización fraccionada; para finalmente, reducirlo a su sal de cloruro utilizando hidrógeno.
Identificado y aislado una sal del nuevo elemento rubidio, los químicos alemanes solo les faltaba reducirlo a su estado metálico. Para lograrlo lo intentaron por dos vías: aplicar al cloruro de rubidio una electrólisis, o calentar una sal más fácil de reducir, como su tartrato. Fue así, que nació el rubidio metálico.
Metal blando de color gris plateado. Es tan suave que parece una mantequilla. Usualmente viene empacado dentro de unas ampollas de vidrio, dentro de las cuales predomina una atmósfera inerte que lo protege de reaccionar con el aire.
37
85,4678 g/mol
39 ºC
688 ºC
A temperatura ambiente: 1,532 g/cm3
En el punto de fusión: 1,46 g/cm3
La densidad del rubidio es superior a la del agua, por lo que se hundirá mientras reacciona violentamente con ella.
2,19 kJ/mol
69 kJ/mol
0,82 en la escala de Pauling
46,9 kJ/mol
-Primera: 403 kJ/mol (Rb+ gaseoso)
-Segunda: 2632,1 kJ/mol (Rb2+ gaseoso)
-Tercera: 3859,4 kJ/mol (Rb3+ gaseoso)
248 pm (empírico)
58,2 W/(m·K)
128 nΩ·m a 20 °C
0,3. Por lo tanto, incluso el talco es más duro que el rubidio metálico.

El rubidio es uno de los metales alcalinos más reactivos, después de cesio y francio. Apenas se expone al aire comienza a arder, y si se le golpea dispara chispas luminosas. Si se le calienta, además emite una llama violeta (imagen superior), la cual es una prueba positiva para los iones Rb+.
Reacciona con el oxígeno para formar una mezcla de peróxidos (Rb2O2) y superóxidos (RbO2). Aunque no reacciona con los ácidos y bases, sí lo hace violentamente con el agua, generando hidróxido de rubidio y gas hidrógeno:
Rb(s) + H2O(l) => RbOH(ac) + H2(g)
Reacciona con el hidrógeno para formar su hidruro correspondiente:
Rb(s) + H2(g) => 2RbH(s)
Y también con los halógenos y el azufre de manera explosiva:
2Rb(s) + Cl2(g) => RbCl(s)
2Rb(s) + S(l) => Rb2S(s)
Aunque el rubidio no se considere un elemento tóxico, es potencialmente peligroso y representa riesgos de incendios cuando entra en contacto con el agua y el oxígeno.
Los átomos de rubidio se disponen ordenadamente de tal manera que establecen un cristal de estructura cúbica centrada en el cuerpo (bcc, por sus siglas en inglés body centered cubic). Esta estructura es característica para los metales alcalinos, los cuales son livianos y tienden a flotar sobre el agua; excepto del rubidio para abajo (cesio y francio).
En los cristales bcc de rubidio, sus átomos Rb interaccionan unos con otros gracias al enlace metálico. Este viene regido por un “mar de electrones” de su capa de valencia, del orbital 5s de acuerdo a su configuración electrónica:
[Kr] 5s1
Todos los orbitales 5s con su único electrón se traslapan en todas las dimensiones de los cristales metálicos de rubidio. Sin embargo, estas interacciones son débiles, pues a medida que se desciende por el grupo de los metales alcalinos los orbitales se vuelven más difusos y, por lo tanto, se debilita el enlace metálico.
Es por eso que el punto de fusión del rubidio es de 39 ºC. Asimismo, su enlace metálico débil explica la blandura de su sólido; tan blando que pareciera ser una mantequilla plateada.
No hay suficiente información bibliográfica respecto al comportamiento de sus cristales bajo altas presiones; si hay fases más densas con propiedades únicas como sucede con el sodio.
Su configuración electrónica indica de una vez que el rubidio tiende fuertemente a perder su único electrón para volverse isoelectrónico al gas noble kriptón. Cuando lo hace, se forma el catión monovalente Rb+. Se dice entonces que en sus compuestos tiene número de oxidación +1 cuando se asume la existencia de este catión.
Debido a la tendencia del rubidio por oxidarse, la suposición de que existan los iones Rb+ en sus compuestos es acertada, lo cual a su vez señala el carácter iónico de estos compuestos.
En casi todos los compuestos del rubidio este exhibe un número de oxidación de +1. Ejemplos de ellos son los siguientes:
-Cloruro de rubidio, RbCl (Rb+Cl–)
-Hidróxido de rubidio, RbOH (Rb+ OH–)
-Carbonato de rubidio, Rb2CO3 (Rb2+CO32-)
-Monóxido de rubidio, Rb2O (Rb2+O2-)
-Superóxido de rubidio, RbO2 (Rb+O2–)
Aunque sea muy raro, el rubidio también pudiera tener un número de oxidación negativo: el -1 (Rb–). En este caso, se hablaría de un “rubidiuro” si formara compuesto con un elemento menos electronegativo que él, o si se sometiera bajo condiciones especiales y rigurosas.
Hay compuestos donde individualmente cada átomo Rb presenta números de oxidación con valores fraccionarios. Por ejemplo, en el Rb6O (Rb62+O2-) y Rb9O2 (Rb94+O22-) la carga positiva se distribuye entre un conjunto de átomos Rb (clústeres). Así, en el Rb6O el número de oxidación en teoría vendría a ser +1/3; mientras que en el Rb9O2, + 0,444 (4/9).
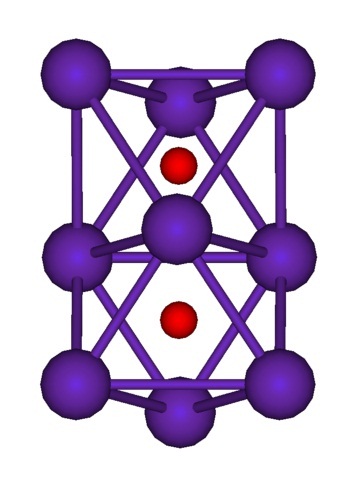
Arriba se muestra la estructura clúster del Rb9O2 representada por un modelo de esferas y barras. Nótese cómo los nueve átomos Rb “encierran” los aniones O2-.
A modo de elucubración, es como si parte de los cristales metálicos originales del rubidio permanecieran inalterados mientras se separan del cristal madre. Pierden electrones en el proceso; los necesarios para atraer a los O2-, y la carga positiva resultante la distribuyen entre todos los átomos de dicho clúster (conjunto o agregados de átomos Rb).
Es así que en estos clústeres de rubidio no puede asumirse formalmente la existencia del Rb+. El Rb6O y Rb9O2 clasifican como subóxidos de rubidio, en los cuales se cumple esta aparente anomalía de haber un exceso de átomos metálicos en relación a los aniones óxidos.

El rubidio es el elemento 23 más abundante de la corteza terrestre, con una abundancia equiparable a la de los metales zinc, plomo, cesio y cobre. El detalle radica en que sus iones se hallan ampliamente difundidos, por lo que no predomina en ningún mineral como elemento metálico principal, y sus menas son además escasas.
Es por esta razón que el rubidio es un metal muy costoso, aun más que el mismo oro, ya que su proceso de obtención a partir de sus menas es complejo por la dificultad de su explotación.
En la naturaleza, dada su reactividad, el rubidio no se encuentra en estado nativo, sino como óxido (Rb2O), cloruro (RbCl) o acompañado de otros aniones. Sus iones “libres” Rb+ se hallan en los mares con una concentración de 125 µg/L, así como en aguas termales y ríos.
Entre los minerales de la corteza terrestre que lo contienen en una concentración menor al 1% tenemos:
-Leucita, K[AlSi2O6]
-Polucita, Cs(Si2Al)O6·nH2O
-Carnalita, KMgCl3· 6H2O
-Zinnwaldita, KLiFeAl(AlSi3)O10(OH, F)2
-Amazonita, Pb,KAlSi3O8
-Petalita, LiAlSi4O10
-Biotita, K(Mg,Fe)3AlSi3O10(OH, F)2
-Rubiclina, (Rb,K)AlSi3O8
-Lepidolita, K(Li,Al)3(Si,Al)4O10(F,OH)2
Todos esos minerales comparten una o dos cosas en común: son silicatos de potasio, cesio o litio, o son sales minerales de estos metales.
Esto significa que el rubidio tiene una fuerte tendencia a asociarse con el potasio y cesio; inclusive, puede sustituir al potasio durante la cristalización de los minerales o rocas, tal como sucede en los yacimientos de las pegmatitas cuando cristaliza el magma. Así pues, el rubidio es un subproducto de la explotación y refinación de estas rocas y sus minerales.
El rubidio también puede hallarse en rocas comunes tales como el granito, arcillas y basalto, y hasta en depósitos carboníferos. De todas las fuentes naturales, la lepidolita representa su mena principal y de la cual se explota comercialmente.
En la carnalita, por otro lado, el rubidio puede hallarse como impurezas de RbCl con un contenido de 0,035%. Y en mayor concentración se tienen los depósitos de polucitas y rubiclinas, los cuales pueden tener hasta un 17% de rubidio.
Su asociación geoquímica con el potasio se debe a la similitud de sus radios iónicos; el Rb+ es más grande que el K+, pero la diferencia de tamaños no es impedimento para que el primero pueda sustituir al segundo en sus cristales minerales.
Ya sea si se parte de la lepidolita o polucita, o de cualquiera de los minerales citados arriba, el desafío sigue siendo el mismo en mayor o menor grado: separar el rubidio del potasio y del cesio; esto es, aplicar técnicas de separación de mezclas que permitan tener los compuestos o sales de rubidio por un lado, y las de potasio y cesio, por el otro.
Esto es difícil ya que estos iones (K+, Rb+ y Cs+) comparten una gran similitud química; reaccionan de igual modo para formar las mismas sales, las cuales apenas difieren entre sí gracias a sus densidades y solubilidades. Es por eso que se recurre a la cristalización fraccionada, de manera que puedan irse cristalizando lenta y controladamente.
Por ejemplo, se utiliza esta técnica para separar una mezcla de carbonatos y alumbre de estos metales. Los procesos de recristalización deben repetirse varias veces para garantizar cristales de mayor pureza y libres de iones coprecipitados; una sal de rubidio que cristaliza con iones K+ o Cs+ sobre su superficie o en su interior.
Técnicas más modernas, como el uso de una resina de intercambio iónico, o de éteres coronas como agentes complejantes, permiten también aislar los iones Rb+.
Una vez se ha logrado separar y purificar la sal de rubidio, el siguiente y último paso consiste en reducir los cationes Rb+ al metal sólido. Para ello, la sal se funde y se le somete a una electrólisis para que precipite rubidio en el cátodo; o se utiliza un agente reductor fuerte, como calcio y sodio, capaces de perder electrones rápidamente y reduzcan así al rubidio.
El rubidio se encuentra en la Tierra como dos isótopos naturales: el 85Rb y 87Rb. El primero tiene una abundancia de 72,17%, mientras que el segundo de 27,83%.
El 87Rb es el responsable de que este metal sea radiactivo; sin embargo, su radiación es inofensiva e inclusive beneficiosa para análisis de datación. Su tiempo de vida media (t1/2) es de 4,9·1010 años, cuyo lapso de tiempo supera a la edad del Universo. Cuando decae, se transforma en el isótopo estable 87Sr.
Gracias a esto se ha utilizado este isótopo para datar la edad de minerales y rocas terrestres presentes desde los inicios de la Tierra.
Además de los isótopos 85Rb y 87Rb, existen otros sintéticos y radiactivos con tiempos de vida variables y mucho más cortos; por ejemplo, el 82Rb (t1/2=76 segundos), 83Rb (t1/2=86,2 días), 84Rb (t1/2=32,9 días) y 86Rb (t1/2=18,7 días). De todos ellos, el 82Rb es el más utilizado en estudios médicos.
El rubidio es un metal tan reactivo que debe almacenarse en ampollas de vidrio bajo una atmósfera inerte para que no reaccione con el oxígeno del aire. Si dicha ampolla se rompe, el metal podrá colocarse en queroseno o aceite mineral para protegerlo; sin embargo, terminará oxidándose por el oxígeno disuelto en ellos, dando lugar a peróxidos de rubidio.
Si por el contrario se decidiera situarlo sobre madera, por ejemplo, esta terminará ardiendo con una llama violeta. Si hay mucha humedad, arderá con el solo hecho de estar expuesto al aire. Cuando un trozo grande de rubidio se avienta a un volumen de agua, explota vigorosamente, llegando hasta incendiar el gas hidrógeno producido.
Por lo tanto, el rubidio es un metal que no cualquiera debe manipular, ya que prácticamente son explosivas todas sus reacciones.
A diferencia del rubidio metálico, sus iones Rb+ no representan ningún riesgo aparente para los seres vivos. Estos disueltos en agua interaccionan con las células del mismo modo como lo hacen los iones K+.
Por lo tanto, el rubidio y el potasio tienen comportamientos bioquímicos similares; sin embargo, el rubidio no es un elemento esencial, mientras que el potasio sí. De esta manera cantidades apreciables de Rb+ pueden acumularse en los interiores de las células, glóbulos rojos y vísceras sin repercutir negativamente en el organismo de cualquier animal.
De hecho, se ha estimado que un hombre adulto con una masa de 80 kg contiene alrededor de 37 mg de rubidio; y que además, un incremento de esta concentración en el orden de 50 a 100 veces no conlleva a síntomas indeseables.
No obstante, un exceso de iones Rb+ puede terminar desplazando a los iones K+; y consecuentemente, el individuo sufrirá espasmos musculares muy fuertes hasta ocasionarle la muerte.
Lógicamente las sales o compuestos solubles de rubidio pueden desencadenar esto de manera inmediata, por lo que ninguna de ellos debería de ingerirse. Además, puede ocasionar quemaduras por simple contacto, y entre los más tóxicos puede citarse el fluoruro (RbF), hidróxido (RbOH) y cianuro (RbCN) de rubidio.
El rubidio se ha utilizado para captar o eliminar los rastros de gases que pueda haber en los tubos sellados al vacío. Precisamente por su alta tendencia a captar el oxígeno y la humedad en ellos, los eliminan sobre su superficie como peróxidos.
Cuando las sales de rubidio arden despiden una llama violeta-rojiza característica. Algunos fuegos artificiales disponen en su composición estas sales para que exploten con estos colores.
El cloruro de rubidio se ha recetado para combatir la depresión, pues estudios determinaron un déficit de este elemento en individuos que padecían esta condición médica. Asimismo se ha utilizado como sedante y para tratar la epilepsia.
Los átomos del isótopo 87Rb se utilizaron para crear el primer condensado de Bose-Einstein. Este estado de la materia consiste en que los átomos a una temperatura bastante próxima al cero absoluto (0 K), se agrupan o “condensan”, comportándose como si fueran uno solo.
Así pues, el rubidio fue protagonista de este triunfo en el campo de la física, y fueron Eric Cornell, Carl Wieman y Wolfgang Ketterle quienes recibieron el Premio Nobel en el 2001 gracias a este trabajo.
El radioisótopo sintético 82Rb decae emitiendo positrones, el cual se utiliza para que se acumule en tejidos ricos en potasio; como aquellos ubicados en el cerebro o corazón. Sirve pues para analizar la funcionalidad del corazón y la presencia de posibles tumores en el cerebro mediante una tomografía por emisión de positrones.
Los iones de rubidio han encontrado sitio en diferentes tipos de materiales o mezclas. Por ejemplo, se han hecho aleaciones suyas con oro, cesio, mercurio, sodio y potasio. Se ha agregado a los vidrios y cerámicas probablemente para aumentar su punto de fusión.
En las celdas solares de perovskitas se han adicionado como un componente importante. Asimismo, se ha estudiado su posible uso como generador termoeléctrico, material de transmisión calorífica en el espacio, combustible en motores de propulsión iónica, medio electrolítico para pilas alcalinas y en magnetómetros atómicos.
Con el rubidio y cesio se han fabricado los famosos relojes atómicos, altamente precisos, utilizados por ejemplo en los satélites GPS con los cuales los dueños de sus teléfonos inteligentes pueden saber su ubicación mientras se desplazan en una carretera.
- Bond Tom. (29 de octubre de 2008). Rubidium. Recuperado de: chemistryworld.com
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Rubidium. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Rubidium. PubChem Database. CID=5357696. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Chellan, P., & Sadler, P. J. (2015). The elements of life and medicines. Philosophical transactions. Series A, Mathematical, physical, and engineering sciences, 373(2037), 20140182. doi:10.1098/rsta.2014.0182
- Mayo Foundation for Medical Education and Research. (2019). Rubidium Rb 82 (Intravenous Route). Recuperado de: mayoclinic.org
- Marques Miguel. (s.f.). Rubidium. Recuperado de: nautilus.fis.uc.pt
- James L. Dye. (12 de abril de 2019). Rubidium. Encyclopædia Britannica. Recuperado de: britannica.com
- Dr. Doug Stewart. (2019). Rubidium Element Facts. Chemicool. Recuperado de: chemicool.com
- Michael Pilgaard. (10 de mayo de 2017). Rubidium Chemical Reactions. Recuperado de: pilgaardelements.com
