Punto de equivalencia: qué es, definición y para qué sirve

¿Qué es el punto de equivalencia?
El punto de equivalencia es aquel en el que han reaccionado completamente dos sustancias químicas. En las reacciones ácido-base, este punto indica cuándo todo un ácido o una base ha sido neutralizado.
Este concepto es cotidiano en las titulaciones o valoraciones volumétricas, y se determina mediante cálculos matemáticos simples.
Al respecto, una titulación es el proceso en el cual se agrega, cuidadosamente, un volumen de una solución de concentración conocida, llamada titulante, a una solución de concentración desconocida, con el fin de obtener su concentración.
El uso de un indicador de pH permite conocer el momento en el cual finaliza la titulación. El indicador es añadido a la solución que se está titulando para hacer la cuantificación de la concentración que se desea conocer.
Un indicador ácido-base es un compuesto químico cuyo color depende de la concentración de hidrógeno o pH del medio.
El cambio de color del indicador señala el punto final de la titulación, aunque no el punto de equivalencia. Idealmente, ambos puntos deben coincidir, pero en la realidad, el cambio de color puede darse unas pocas gotas después de haberse completado la neutralización del ácido o la base.
¿En qué consiste el punto de equivalencia?
Se puede titular una solución de un ácido de concentración desconocida colocada en un matraz, agregando lentamente una solución de hidróxido de sodio de concentración conocida mediante el uso de una bureta.
La selección de un indicador debe hacerse de tal manera que cambie de color en el punto que hayan reaccionado la misma cantidad de equivalentes químicos de la solución titulante y de la solución de concentración desconocida.
Este es el punto de equivalencia, mientras el punto en el cual un indicador cambia de color se llama punto final, donde finaliza la titulación.
Punto final
La ionización o disociación del indicador se representa en la forma siguiente:
HIn + H₂O => In– + H3O+
Y tiene, por tanto, una constante Ka
Ka = [H3O+][In–] / [HIn]
La relación entre el indicador no disociado (HIn) y el indicador disociado (In–) determina el color del Indicador.
La adición de un ácido aumenta la concentración de HIn y produce el color 1 del indicador. Mientras, la adición de una base favorece un aumento de la concentración del indicador disociado (In–) (color 2).
Es deseable que el punto de equivalencia coincida con el punto final. Para ello, se selecciona un indicador con un intervalo de cambio de color que incluya el punto de equivalencia. Además, se trata de reducir cualquier error que produzca una diferencia entre el punto de equivalencia y el punto final.
La estandarización o valoración de una solución es un proceso donde se determina la concentración exacta de una solución. Es metodológicamente una titulación, pero la estrategia seguida es diferente.
Se coloca en el matraz una solución del estándar primario y se va agregando con una bureta la solución titulante que está siendo estandarizada.
Punto de equivalencia de la titulación de un ácido fuerte con una base fuerte
Se coloca en el matraz 100 mL de HCl 0,1 M y se va agregando gradualmente, mediante una bureta, una solución de NaOH 0,1 M, determinándose los cambios de pH de la solución que origina el ácido clorhídrico.
Inicialmente, antes de agregar NaOH, el pH de la solución de HCl es 1.
Se va agregando la base fuerte (NaOH) y el pH se va incrementando gradualmente, pero sigue siendo un pH ácido, ya que el exceso de ácido determina este pH.
Si se continúa agregando NaOH, llega un momento en que se alcanza el punto de equivalencia, donde el pH es neutro (pH=7). El ácido ha reaccionado con la base consumiéndose, pero no hay un exceso de base todavía.
Predomina la concentración del cloruro de sodio, que es una sal neutra (ni el Na+ ni el Cl– se hidrolizan).
Si se continúa agregando NaOH, el pH sigue aumentando, haciéndose más básico que el punto de equivalencia, debido a que predomina la concentración de NaOH.
Idealmente, el cambio de color del indicador debe ocurrir a un pH=7, pero debido a la forma brusca de la curva de titulación, puede usarse la fenolftaleína que cambia a un color rosado pálido a un pH alrededor de 8.
Curva de titulación ácido débil- base fuerte
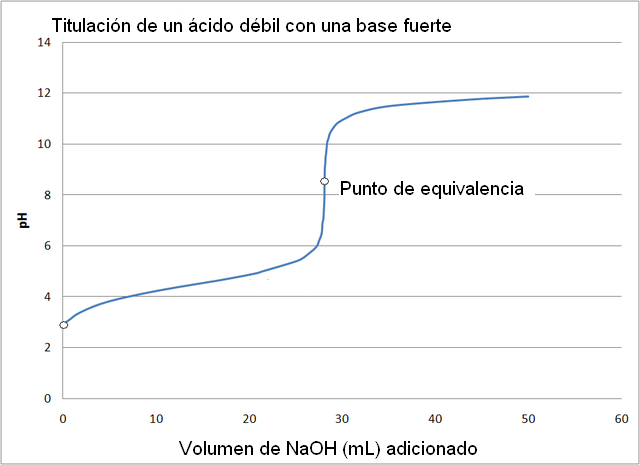
La curva de titulación de un ácido fuerte con una base fuerte es parecida a la de la imagen superior. La única diferencia entre ambas curvas, es que la primera tiene un cambio de pH mucho más brusco, mientras que en la curva de titulación de un ácido débil con una base fuerte, puede observarse que el cambio es más paulatino.
En este caso se titula un ácido débil, como el ácido acético (CH3COOH) con una base fuerte, el hidróxido de sodio (NaOH). La reacción que ocurre en la titulación puede esquematizarse en la forma siguiente:
NaOH + CH3COOH => CH3COO–Na+ + H₂O
En este caso se forma la solución amortiguadora acetato con un pKa = 4,74. La región amortiguada puede apreciarse en el leve y casi imperceptible cambio antes del pH 6.
El punto de equivalencia, tal como indica la imagen, se encuentra alrededor de 8,72 y no 7. Esto es porque el CH3COO– es un anión que tras hidrolizarse genera OH–, el cual basifica el pH:
CH3COO– + H₂O => CH3COOH + OH–
Etapas
La titulación del ácido acético por el hidróxido de sodio puede dividirse en 4 etapas para su análisis.
– Antes de comenzar a agregar la base (NaOH), el pH de la solución es ácido y depende de la disociación del ácido acético.
– A medida que se va agregando hidróxido de sodio se va formando la solución amortiguadora acetato, pero de la misma forma se va incrementando la formación de la base conjugada acetato, lo cual trae consigo un incremento del pH de la solución.
– El pH del punto de equivalencia ocurre a un pH de 8,72, el cual es francamente alcalino.
El punto equivalencia no tiene un valor constante y varía dependiendo de los compuestos que intervienen en la titulación.
– Al continuar agregando NaOH, después de alcanzar el punto de equivalencia, el pH va incrementándose debido a un exceso de hidróxido de sodio.
Selección del indicador de acuerdo al punto de equivalencia
La fenolftaleína es útil en la determinación del punto de equivalencia en esta titulación, debido a que tiene su punto de viraje de color en un pH alrededor de 8, el cual cae en la zona de pH de la titulación del ácido acético que incluye el punto de equivalencia (pH=8,72).
Por otro lado, el rojo de metilo no es útil en la determinación del punto de equivalencia, ya que cambia de color en el intervalo de pH de 4,5 a 6,4.
Referencias
- Helmenstine, Anne Marie. Equivalence Point Definition. Recuperado de thoughtco.com
- Difference Between Endpoint and Equivalence Point. Recuperado de differencebetween.net
- Equivalence Point: Definition & Calculation. Recuperado de study.com
