Bromuro de potasio (KBr): estructura, propiedades, usos
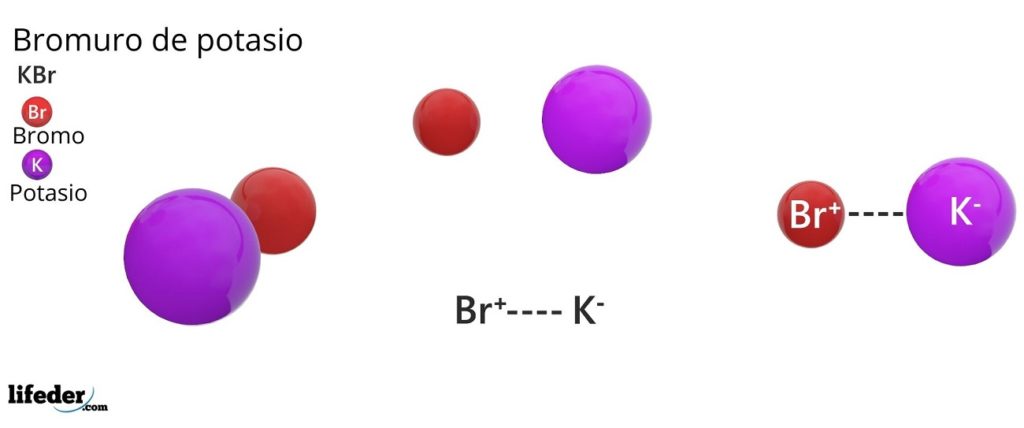
El bromuro de potasio es una sal inorgánica cuya fórmula química es KBr. Está formada por la unión electrostática de un anión bromuro, Br–, y un catión potasio, K+, en una proporción 1:1; es decir, tenemos la misma cantidad de Br– como de K+ en los cristales de KBr.
El bromuro de potasio es una sal sólida de color blanco o cristalino, es inodora, muy soluble en el agua, y poco soluble en el etanol y en el éter. Fue usado durante la parte final del siglo XIX y gran parte del siglo XX en el tratamiento de la epilepsia y como sedativo.
Hasta 1975 se siguió vendiendo libremente, año en que disminuyó su uso por los efectos tóxicos que producía sobre los pacientes. Actualmente se sigue usando en varias especies de animales en el tratamiento de las convulsiones, aunque a partir de 1912 fue sustituido por el fenobarbital sódico.
El bromuro de potasio se emplea en estudios ópticos correspondientes a la región del infrarrojo cercano del espectro electromagnético. Asimismo, sirve como material empleado en el campo de la fotografía.
Índice del artículo
- 1 Tipo de enlace
- 2 Estructura del bromuro de potasio
- 3 Nomenclatura
- 4 Propiedades del bromuro de potasio
- 4.1 Aspecto físico
- 4.2 Olor
- 4.3 Sabor
- 4.4 Masa molar
- 4.5 Densidad
- 4.6 Punto de fusión
- 4.7 Punto de ebullición
- 4.8 Solubilidad en agua
- 4.9 Solubilidad en glicerol
- 4.10 Solubilidad en etanol
- 4.11 Densidad de vapor
- 4.12 Estabilidad
- 4.13 Descomposición
- 4.14 Índice de refracción (nD)
- 4.15 pH
- 4.16 Punto de ignición
- 4.17 Disolución y reactividad
- 5 Usos
- 6 Referencias
El bromuro de potasio es una sal binaria, producto de la combinación de un átomo de bromo con un estado de oxidación -1, con un átomo de potasio de con un estado de oxidación +1. Por lo tanto, se establece una atracción eléctrica entre el ion Br– y el ion K+.
Este tipo de interacción eléctrica o electrostática es conocida como un enlace iónico, el cual se disocia cuando la sal bromuro de potasio se disuelve en el agua, liberándose los iones K+ y Br–.
Estos iones son disgregados por la propiedad del agua de mantener separadas las cargas eléctricas de signo contrario.

El bromuro de potasio presenta una estructura cristalina cúbica centrada en la cara (fcc por sus siglas en inglés: face-centered cubic), igual a la observada en el cloruro de sodio.
En esta estructura, cada anión Br– se encuentra enlazado o coordinado con seis cationes K+, y a su vez, cada K+ tiene seis Br– como vecinos en las redes cristalinas.
El bromuro de potasio es clasificado como un haluro o halogenuro de metal alcalino. Los nombres de estas sales se construyen eliminando la letra final del nombre del halógeno (cloro, bromo, yodo, flúor y astato), a excepción del flúor, y sustituyendo la letra final por el sufijo -uro. A continuación se escribe sin modificación el nombre del metal.
Por ejemplo: cloruro de sodio, yoduro de potasio, fluoruro de calcio, etc. Es por eso que el KBr se llama bromuro de potasio o bromuro potásico (según la nomenclatura tradicional).

Cristal incoloro, polvo o gránulos cristalinos o blancos.
Inodoro
A una concentración elevada tiene un sabor amargo y picante.
119.02 g/mol
2.74 g/cm3 a 25 ºC
734 ºC
1435 ºC
535 g/L a 0 ºC
678 g/L a 25 ºC
1020 g/L a 100 ºC
1 gramo de la sal se disuelve en 1 mL de agua hirviendo, lo cual indica que es muy soluble en agua.
217 g/L
1 gramo de bromuro de potasio se disuelve en 4.6 mL de glicerol.
47.6 g/L a 80 ºC.
1 gramo de bromuro de potasio se disuelve en 250 mL de etanol.
7.14 en relación al aire tomado como la unidad.
Estable si se almacena bajo las condiciones recomendadas. Incompatible con agentes oxidantes, ácidos fuertes, trifluoruro de bromo y tricloruro de bromo.
Cuando se calienta a descomposición emite productos dañinos, como bromuro de hidrógeno y óxido de potasio.
1.559
En solución acuosa produce un pH neutro, alrededor de 7.
1435 ºC
En solución acuosa el KBr se disocia completamente para originar una solución de pH neutro.
La sal es una fuente de bromuro que puede ser usada para la producción de bromuro de plata, AgBr, compuesto utilizado en el revelado de las fotografías:
KBr (ac) + AgNO3 (ac) → AgBr (s) + KNO3 (ac)
Asimismo, el KBr es un agente reductor débil, incompatible con sales de mercurio y plata. Produce una reacción violenta con el trifluoruro de bromo. Puede reaccionar con muchas sales, alcaloides y el almidón.
También reacciona con ácidos, por ejemplo, con el ácido sulfúrico concentrado, liberando bromuro de hidrógeno.
Las propiedades anticonvulsivas del bromuro de potasio fueron expuestas por vez primera por Sir Charles Locock, en una reunión del Royal Medicine y Chirurgical Society en 1857, lo que impulsó su uso en el tratamiento de la epilepsia.
Se usó el bromuro de potasio como el medicamento prioritario en el tratamiento de la epilepsia y como sedativo hasta el año de 1912, cuando se dio a conocer el fenobarbital sódico.
Aun así, se siguió usando como un complemento del fenobarbital sódico en el tratamiento de las convulsiones propias de la epilepsia.
En el año de 1975, debido a su carácter tóxico, el FDA U.S. (Food & Drug Administration) decidió no recomendar más el uso del bromuro de potasio, tanto en seres humanos como en animales. Sin embargo, algunos países continuaron administrándolo.
El bromuro de potasio se usó como hipnótico y sedante en el ganado bovino, los caballos, las ovejas y los cerdos. Asimismo fue utilizado en el tratamiento de los cólicos y la tetania en los caballos, y en el tratamiento de las convulsiones en los perros.
Debido a la transparencia del bromuro de potasio en una gama de longitudes de onda comprendidas entre la luz ultravioleta y el infrarrojo cercano, se utiliza como un componente de las ventanas para varias radiaciones electromagnéticas, especialmente las radiaciones infrarrojas.
Se usa varias técnicas al respecto. Una de ellas consiste en la elaboración de dos discos cristalinos de bromuro de potasio, colocándose entre los discos una película del material a analizar en el infrarrojo. Los estudios se realizan en el infrarrojo cercano comprendido entre 780 nm y 3000 nm.

El bromuro de potasio ha tenido numerosos usos y aplicaciones en la fotografía, por ejemplo: se ha empleado para formular reveladores de fotografía, en la fabricación de películas fotográficas, como espesante de películas, y como blanqueador fotográfico en color.
Se utiliza en el mejoramiento de la diferenciación entre los cristales de haluros de plata expuestos y no expuestos, en el aumento de la densidad de impresión de negativos delgados, y como halogenuro secundario, en combinación con yoduros, para el procesamiento de negativos en papel.
También ha sido utilizado en combinación con bicloruro de mercurio, sulfato de cobre o ferricianurio de potasio en blanqueadores fotográficos. Asimismo, ha servido de limitador en reveladores alcalinos utilizados para placas de gelatina y papeles de revelado.
Se usa el KBr en la determinación de la valoración del cobre y de la plata, en el análisis polarográfico del indio, cadmio y arsénico.
Se emplea en los procesos de grabado en litografía, en el procesamiento del petróleo, en la estabilización térmica del nylon, en la fabricación de fibras, y finalmente en la fabricación de jabones especiales.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Day, R., & Underwood, A. (1986). Química Analítica Cuantitativa (quinta ed.). PEARSON Prentice Hall.
- Wikipedia. (2020). Potassium bromide. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2021). Potassium bromide. PubChem Compound Summary for CID 253877. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Emea. (1999). Bromide, Potassium Salt: Summary Report. [PDF]. Recuperado de: ema.europa.eu
- El Sevier B.V. (2020). Potassium Bromide. ScienceDirect. Recuperado de: sciencedirect.com
