Poro nuclear: características, funciones, componentes
El poro nuclear (del griego, poros = paso o tránsito) es la “puerta” del núcleo que permite la mayor parte del transporte entre el nucleoplasma y el citoplasma. El poro nuclear une las membranas interna y externa del núcleo para formar canales, los cuales sirven para el transporte de proteínas y ARN.
La palabra poro no refleja la complejidad de la estructura en cuestión. Debido a ello, es preferible referirse al complejo del poro nuclear (CPN), en lugar de poro nuclear. El CPN puede experimentar cambios en su estructura durante el transporte o estados del ciclo celular.
Recientemente, se ha descubierto que las nucleoporinas, proteínas que conforman el CPN, tienen un papel importante en la regulación de la expresión de los genes. Así, cuando ocurren mutaciones que afectan la función de las nucleoporinas, se producen patologías en los humanos, como las enfermedades autoinmunes, cardiomiopatías, infecciones virales y cáncer.
Índice del artículo
Mediante tomografía de electrones se determinó que el CPN tiene un grosor de 50 nm, un diámetro externo entre 80 y 120 nm, y un diámetro interno de 40 nm. Las moléculas grandes tales como la subunidad grande de los ribosomas (PM 1590 kDa) pueden ser exportadas fuera del núcleo a través del CPN. Se estima que hay entre 2000 y 4000 CPN por núcleo.
El peso molecular de un CPN individual es aproximadamente entre 120 y 125 MDa (1 MDa = 106 Da) en los vertebrados. En contraste, el CPN es más pequeño en las levaduras, en las cuales tiene aproximadamente 60 MDa. A pesar del enorme tamaño del CPN, las nucleoporinas están altamente conservadas en todos los eucariotas.
La translocalización a través del CPN es un proceso rápido, cuya velocidad es 1000 translocalizaciones/segundo. No obstante, el CPN no determina por sí mismo la dirección del flujo de transporte.
Esta dependende del gradiente de RanGTP, el cual es mayor en el núcleo que en el citosol. Este gradiente es mantenido por un factor intercambiador de guanina Ran.
Durante el ciclo celular, los CPN experimentan ciclos ensamblaje y desunión de sus componentes. El ensamblaje sucede en la interfase e inmediatamente después de la mitosis.
El ácido ribonucleico (ARN nuclear pequeño, ARN mensajero, ARN de transferencia), las proteínas y las ribonucleoproteínas (RNP) deben ser transportadon activamente a través de CPN. Esto significa que se requiere la energía de la hidrólisis del ATP y GTP. Cada molécula es transportada de una manera específica.
Por lo general, las moléculas de ARN son empacadas con proteínas formando complejos RNP, siendo exportadas de esta manera. En contraste, las proteínas que son transportadas activamente hacia el núcleo deben poseer una secuencia señal de localización en el núcleo (SLN), poseedora de residuos de aminoácidos con carga positiva (por ejemplo, KKKRK).
Las proteínas que son exportadas al núcleo deben tener una señal de exportación al núcleo (NES) rica en el aminoácido leucina.
Además de facilitar el transporte entre el núcleo y el citoplasma, los CPN están implicados en la organización de la cromatina, la regulación de la expresión de genes y la reparación del ADN. Las nucleoporinas (Nups) promueven la activación o represión de la transcripción, independientemente del estado de proliferación celular.
En las levaduras, las Nups se encuentran en el CNP de la envoltura nuclear. En los metazoarios se encuentran en el interior. Llevan a cabo las mismas funciones en todos los eucariotas.
A través del CPN hay difusión pasiva de moléculas pequeñas en ambas direcciones y transporte activo, importación de proteínas, exportación de ARN y ribonucleoproteínas (RNPs), y la lanzadera de moléculas bidireccional. Esto último incluye ARN, RNP y proteínas implicadas en el señalamiento, biogénesis y recambio.
La importación de proteínas dentro del núcleo sucede en dos pasos: 1) unión de la proteína al lado citoplasmático del CPN; 2) translocalización dependiente de ATP a través del CPN. Este proceso necesita la hidrólisis de ATP y el intercambio de GTP/GDP entre el núcleo y el citoplasma.
De acuerdo con un modelo de transporte, el complejo receptor-proteína se mueve a lo largo del canal mediante la unión, disociación y unión nuevamente a las secuencias repetidas de FG de las nucleoporinas. De esta forma, el complejo se mueve de una nucleoporina a otra en el interior del CPN.
Es similar a la importación. Ran GTPasa impone la direccionalidad sobre el transporte a través de CNP. Ran es un interruptor molecular con dos estados conformacionales, dependiendo si está unido al GDP o al GTP.
Dos proteínas reguladoras específicas de Ran disparan la conversión entre los dos estados: 1) proteína activadora de GTPasa citosólica (GAP), que produce la hidrólisis de GTP y así convierte Ran-GTP a Ran-GDP; y 2) factor intercambiador de guanina nuclear (GEF), que promueve el intercambio de GDP por GTP y convierte Ran-GDP a Ran-GTP.
El citosol contiene principalmente Ran-GDP. El núcleo contiene principalmente Ran-GTP. Este gradiente de las dos formas conformacionales de Ran dirige el transporte en la dirección apropiada.
La importación del receptor, unido al cargo, es facilitado por la unión a las repeticiones-FG. Si alcanza el lado nuclear del CNP, Ran-GTP se une al receptor para que libere su cargo. Así, Ran-GTP crea la dirección del proceso de importación.
La exportación nuclear es similar. No obstante, Ran-GTP en el núcleo promueve la unión del cargo al receptor exportación. Cuando el receptor de exportación se mueve a través del poro hacia el citosol, se encuentra con Ran-GAP, el cual induce la hidrólisis de GTP a GDP. Finalmente, se libera el receptor de su cargo y Ran-GDP en el citosol.
La exportación de algunas clases de ARN es similar a la exportación de proteínas. Por ejemplo, el ARNt y ARNns (nuclear pequeño) usan el gradiente RanGTP y son transportados a través del CPN mediante carioferina exportina-t y Crm, respectivamente. La exportación de ribosomas maduros también es dependiente del gradiente RanGTP.
El ARNm es exportado de una manera muy diferente al de las proteínas y otros ARN. Para su exportación, el ARNm forma un complejo de RNP mensajero (RNPm), en el cual una molécula de ARNm está rodeada de cientos de moléculas de proteínas. Estas proteínas tienen como función el procesamiento, capping, empalme y poliadenilación del ARNm.
La célula debe ser capaz de distinguir entre RNPm con ARNm maduro y RNPm con ARNm inmaduro. El ARNm, que forma el complejo RPNm, podría adoptar topologías que necesitan remodelarse para el transporte. Antes de que RNPm entre en el CPN, ocurre un paso de control llevado a cabo por TRAMP y complejos de proteína del exosoma.
Cuando el RNPm maduro está ensamblado, el RPNm es transportado a través del canal mediante un receptor de transporte (Nxf1-Nxt1). Este receptor necesita la hidrólisis de ATP (no un gradiente RanGTP) para establecer la direccionalidad remodelando del RNPm, el cual alcanzará el citoplasma.
Algunos estudios indican que los componentes del CPN podrían influenciar la regulación de la expresión genética mediante el control de la estructura de la cromatina y su accesibilidad a los factores de transcripción.
En eucariotas de evolución más reciente, la heterocromatina está localizada preferencialmente en la periferia del núcleo. Este territorio es interrumpido por canales de eucromatina, los cuales son mantenidos por la cesta nuclear del CPN. La asociación cesta nuclear con eucromatina está relacionada con la transcripción de genes.
Por ejemplo, la activación de la transcripción a nivel del CPN implica la interacción de los componentes de la cesta nuclear con proteínas tales como la SAGA acetiltransferasa de la histona y factores de exportación del ARN.
Así, la cesta nuclear es una plataforma para numerosos genes de mantenimiento (housekeeping) altamente transcritos y genes inducidos fuertemente por cambios en las condiciones medioambientales.
La infección viral de células eucariotas depende del CPN. En cada caso de infección viral, su éxito depende de que el ADN, el ARN o el RPN pase a través del CPN para alcanzar su objetivo final, que es la replicación del virus.
El virus de simio 40 (SV40) ha sido uno de los modelos más estudiados para investigar la función del CPN en la translocalización dentro del núcleo. Esto se debe a que SV40 posee un genoma pequeño (5.000 bases).
Se ha demostrado que el transporte del ADN del virus es facilitado proteínas de la cubierta del virus, que protegen al virus hasta que alcanza el núcleo.
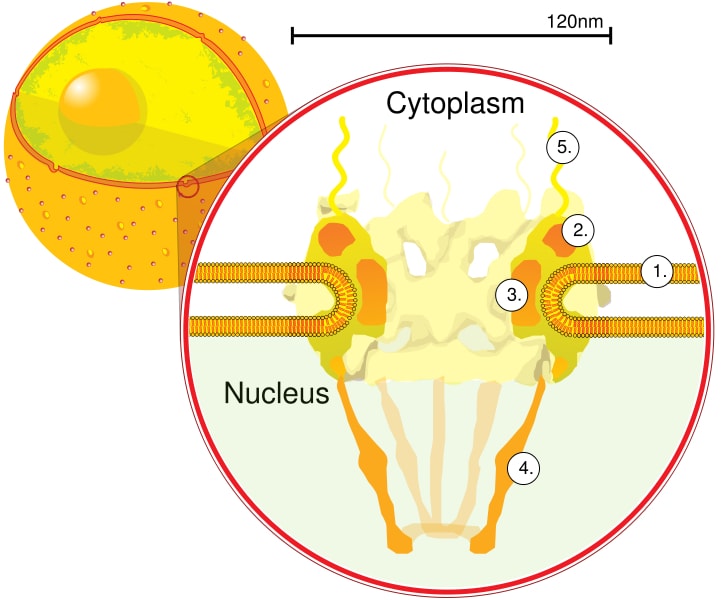
El CPN está embebido en el interior de la envoltura nuclear y está conformado por entre 500 y 1000 Nups, aproximadamente. Estas proteínas están organizadas en subcomplejos estructurales o módulos, los cuales interactúan unos con otros.
El primer módulo es un componente central, o anillo, en el interior del poro con forma de reloj de arena, que está limitado por otro anillo de 120 nm de diámetro sobre ambas caras, intranuclear y citoplasmática. El segundo módulo son los anillos del núcleo y el citoplasma (120 nm de diámetro cada uno) localizados alrededor del componente en forma de reloj de arena.
El tercer módulo son ocho filamentos que se proyectan desde el anillo de 120 nm dentro del nucleoplasma y forma una estructura en forma de cesta. El cuarto módulo los conforman los filamentos que se proyectan hacia el lado del citoplasma.
El complejo en forma de Y, constituido por seis Nups y las proteínas Seh 1 y Sec 13, es el complejo más grande y mejor caracterizado del CNP. Este complejo es la unidad esencial que forma parte del andamiaje del CPN.
A pesar de la baja similitud entre las secuencias de las Nups, el andamiaje del CPN está altamente conservado en todos los eucariotas.
- Beck, M., Hurt, E. 2016. The nuclear pore complex: understanding its function through structural insight. Nature Reviews, Molecular Cell Biology, Doi:10.1038/nrm.2016.147.
- Ibarra, A., Hetzer, M.W. 2015. Nuclear pore proteins and the control of genome functions. Genes and Development, 29, 337–349.
- Kabachinski, G., Schwartz, T.U. 2015. The nuclear pore complex – structure and function at a glance. Journal of Cell Science, 128, 423–429.
- Knockenhauer, K.E., Schwartz, T.U. 2016. The nuclear pore complex as a flexible and dynamic gate. Cell, 164, 1162–1171.
- Ptak, C., Aitchison, J.D., Wozniak, R.W. 2014. The multifunctional nuclear pore complex: a platform for controlling gene expression. Current Opinion of Cell Biology, DOI:10.1016/j.ceb.2014.02.001.
- Stawicki, S.P., Steffen, J. 2017. Republication: the nuclear pore complex ‑ a comprehensive review of structure and function. International Journal of Academic Medicine, 3, 51–59.
- Tran, E.J., Wente, S.R. 2006. Dynamic nuclear pore complexes: life on the edge. Cell, 125, 1041–1053.
