Hidróxido de amonio: qué es, estructura, propiedades, riesgos, usos
¿Qué es el hidróxido de amonio?
El hidróxido de amonio es un compuesto de fórmula molecular NH4OH o H5NO que se produce por la disolución del gas amoníaco (NH3) en agua. Por esta razón, recibe los nombres de agua de amoníaco o amoníaco líquido.
Se trata de un líquido incoloro y de un olor muy intenso y agudo, no aislable. Estas características tienen una relación directa con la concentración de NH3 disuelto en el agua, concentración que puede abarcar enormes cantidades de amoníaco disueltas en poco volumen de agua, pues se trata de un gas.
Una parte considerablemente pequeña de estas soluciones acuosas está compuesta por los cationes NH4+ y los aniones OH–.
Por otro lado, en soluciones muy diluidas o en sólidos congelados a muy bajas temperaturas, el amoníaco puede encontrarse en forma de hidratos, como: NH3∙H2O, 2NH3∙H2O y NH3∙2H2O.
Estructura química del hidróxido de amonio
El hidróxido de amonio consiste en una solución acuosa de gas amoníaco. Por lo tanto, en el seno del líquido, no existe una estructura definida que no sea la de una disposición aleatoria de los iones NH4+ y OH– solvatados por las moléculas de agua.
Los iones amonio e hidroxilo son producto de un equilibrio de hidrólisis del amoníaco, por lo que es común que estas soluciones presenten un olor penetrante:
NH3(g) + H2O(l) => NH4+(ac) + OH–(ac)
De acuerdo a la ecuación química, una disminución elevada de la concentración del agua desplazaría el equilibrio a la formación de más amoníaco, es decir, a medida que se calienta el hidróxido de amonio se liberarán vapores de amoníaco.
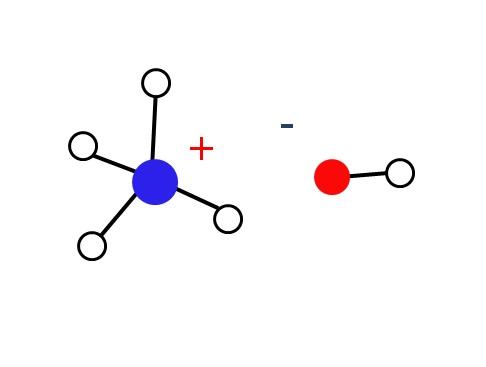
Por esta razón, los iones NH4+ y OH– no logran formar un cristal en las condiciones terrestres, lo que trae como consecuencia que la base sólida NH4OH no exista.
Dicho sólido debería estar compuesto solamente de iones interaccionando electrostáticamente (como se aprecia en la imagen).
Propiedades físicas y químicas
Fórmula molecular
NH4OH o H5NO
Peso molecular
35,046 g/mol
Aspecto
Líquido incoloro.
Concentración
Hasta aproximadamente un 30% (para los iones NH4+ y OH–).
Olor
Muy fuerte y agudo.
Sabor
Acre.
Valor umbral
34 ppm para una detección inespecífica.
Punto de ebullición
38 ºC (25%).
Solubilidad
Existe solo en solución acuosa.
Solubilidad en agua
Miscible en ilimitadas proporciones.
Densidad
0,90 g/cm3 a 25 ºC.
Densidad del vapor
Relativo al aire tomado como la unidad: 0,6. Es decir, es menos denso que el aire. Sin embargo, lógicamente el valor reportado alude al amoníaco como gas, no a sus soluciones acuosas o al NH4OH.
Presión de vapor
2.160 mmHg a 25 ºC.
Acción corrosiva
Es capaz de disolver el cinc y el cobre.
pH
11,6 (solución 1 N); 11,1 (solución 0,1 N) y 10,6 (solución 0,01 N).
Constante de disociación
pKb = 4,767; Kb = 1,71 x 10-5 a 20 ºC
pKb = 4,751; Kb = 1,774 x 10-5 a 25 º C
El aumento de la temperatura incrementa casi imperceptiblemente la basicidad del hidróxido de amonio.
Nomenclatura
El NH4OH recibe nombres comunes y oficiales, de acuerdo a lo establecido por la IUPAC. Su nombre es hidróxido de amonio por contener al anión hidroxilo.
El amonio por su carga +1 es monovalente, por lo que empleando la nomenclatura Stock se le nombra como hidróxido de amonio (I).
Pero el uso de “hidróxido de amonio” es técnicamente incorrecto, pues el compuesto no es aislable (al menos no en la Tierra, tal como se explicó en el primer apartado).
También recibe los nombres de agua de amoníaco y amoníaco líquido.
Solubilidad
Como el NH4OH no existe como sal en las condiciones terrestres, no puede estimarse qué tan soluble es en diferentes solventes.
Sin embargo, cabría esperar que fuera extremadamente soluble en agua, ya que su disolución liberaría enormes cantidades de NH3.
Teóricamente, sería una manera asombrosa de almacenar y transportar amoníaco.
En otros solventes capaces de aceptar puentes de hidrógeno, como los alcoholes y las aminas, podría esperarse que fuera también muy soluble en ellos. Aquí el catión NH4+ es un donador de puentes de hidrógeno, y el OH– funge como ambos.
Ejemplos de estas interacciones con metanol serían: H3N+-H — OHCH3 y HO– — HOCH3 (OHCH3 indica que el oxígeno recibe el puente de hidrógeno, no que el grupo metilo esté enlazado con el H).
Riesgos
– En contacto con los ojos ocasiona irritación que puede llevar a daño ocular.
– Es corrosivo. Por lo tanto, al contacto con la piel puede producir irritación, y a concentraciones elevadas del reactivo, provoca quemaduras de la piel. El contacto repetido del hidróxido de amonio con la piel puede causar su resequedad, picazón y enrojecimiento (dermatitis).
– La inhalación de un rocío de hidróxido de amonio, puede provocar irritación aguda de las vías respiratorias, caracterizada por asfixia, tos o falta de aire.
– La exposición prolongada o repetida de la sustancia puede resultar en infecciones recurrentes de los bronquios. Asimismo, la inhalación de hidróxido de amonio puede provocar irritación de los pulmones.
– La exposición a concentraciones elevadas del hidróxido de amonio podría constituir una emergencia médica, ya que puede producirse una acumulación de líquido en los pulmones (edema pulmonar).
– Se ha tomado la concentración de 25 ppm como un límite de exposición, en un turno laboral de 8 horas, en un ambiente donde el trabajador se encuentre expuesto a la acción nociva del hidróxido de amonio.
Reactividad
Además del daño potencial para la salud por la exposición al hidróxido de amonio, hay otros cuidados que deben ser tomados en cuenta cuando se trabaja con la sustancia.
– El hidróxido de amonio puede reaccionar con muchos metales, como: plata, cobre, plomo y cinc. También reacciona con las sales de estos metales para formar compuestos explosivos y liberar el gas hidrógeno, el cual, a su vez, es inflamable y explosivo.
– Puede reaccionar en forma violenta con los ácidos fuertes, por ejemplo: ácido clorhídrico, ácido sulfúrico y ácido nítrico. Asimismo, reacciona en la misma forma con el sulfato de dimetilo y los halógenos.
– Reacciona con las bases fuertes, como el hidróxido de sodio y el hidróxido de potasio, produciendo amoníaco gaseoso. Esto puede comprobarse si se observa el equilibrio en solución, en el cual la adición de iones OH– desplaza el equilibrio a la formación de NH3.
– No deben usarse los metales cobre y aluminio, así como otros metales galvanizados, cuando se manipule el hidróxido de amonio, debido a su acción corrosiva sobre ellos.
Usos
En los alimentos
– Se usa como aditivo en muchos alimentos en los que cumple funciones de agente leudante, control del pH y agente del acabado de la superficie de los alimentos.
– La lista de los alimentos en los cuales se usa el hidróxido de amonio es extensa e incluye productos horneados, quesos, chocolates, caramelos y pudines.
– El hidróxido de amonio se cataloga como una sustancia inocua por la FDA para el procesamiento de los alimentos, siempre que se sigan las normas establecidas.
– En los productos cárnicos se utiliza como agente antimicrobiano, pudiendo eliminar bacterias como la E. coli, reduciéndola a niveles indetectables. La bacteria se encuentra en el intestino del ganado, adaptándose al medio ácido. El hidróxido de amonio, al regular el pH, dificulta el crecimiento bacteriano.
Terapéuticos
El hidróxido de amonio tiene varios usos terapéuticos, entre ellos:
– Se usa la solución al 10% como estimulante del reflejo respiratorio.
– Externamente se usa sobre la piel para el tratamiento de picaduras de insectos y mordeduras.
– Actúa en el sistema digestivo como antiácido y carminativo, es decir, que ayuda a la eliminación de los gases.
– Se utiliza como rubefaciente en forma tópica para el dolor osteomuscular agudo y crónico. Como consecuencia de esta acción, se produce un aumento local del flujo sanguíneo, enrojecimiento e irritación.
Industriales y misceláneos
– Actúa en la reducción del NOx (gases muy reactivos como el óxido nítrico (NO) y el dióxido de nitrógeno (NO2)) para las emisiones de pilas y reducción de NOx en las emisiones de las chimeneas.
– Se utiliza como agente plastificante, aditivo de las pinturas y para el tratamiento de las superficies.
– Aumenta la porosidad de los cabellos permitiendo que los pigmentos de tintes tengan mayor penetración, lo cual logra un mejor acabado.
– El hidróxido de amonio se utiliza como un agente antimicrobiano en el tratamiento de las aguas residuales. Además, interviene en la síntesis de la cloramina. Esta sustancia cumple una función semejante al cloro en la purificación del agua de las piscinas, teniendo la ventaja de ser menos tóxica.
– Se utiliza como un inhibidor de la corrosión en el proceso de refinación del petróleo.
– Se usa como agente de limpieza en varios productos industriales y comerciales, siendo utilizado en varias superficies, entre ellas, acero inoxidable, porcelana, vidrio y hornos.
– Se usa en la producción de detergentes, jabones, productos farmacéuticos y tintas.
En la agricultura
– Aunque no se administra directamente como fertilizante, el hidróxido de amonio cumple esta función. El amoníaco se produce a partir del nitrógeno atmosférico por el método de Haber-Bosch y se transporta refrigerado por debajo de su punto de ebullición (-33 ºC) a los sitios de su utilización.
– El amoníaco presurizado se inyecta, en forma de vapor, al interior del suelo, donde reacciona inmediatamente con el agua edáfica y pasa a la forma de amonio (NH4+), el cual queda retenido en los sitios de intercambio catiónico del suelo. Además, se produce el hidróxido de amonio. Estos compuestos son una fuente de nitrógeno.
– Junto con el fósforo y el potasio, el nitrógeno constituye la triada de nutrientes principales de las plantas imprescindibles para su crecimiento.
Referencias
- Helmenstine, Anne Marie, Ph.D. Ammonium Hydroxide Facts. Recuperado de thoughtco.com
- Hoja informativa sobre sustancias peligrosas: hidróxido de amonio [PDF]. Recuperado de nj.gov
- Ammonium Hydroxide. Recuperado de chemistrylearner.com
