Alcohol terciario: estructura, propiedades, ejemplos
Un alcohol terciario es aquel en el cual el grupo hidroxilo, OH, se halla enlazado a un carbono terciario. Su fórmula continúa siendo ROH, al igual que otros alcoholes; pero se le reconoce fácilmente porque el OH está cercano a una X en la estructura molecular. Asimismo, su cadena carbonada suele ser más corta, y su masa molecular mayor.
Entonces, un alcohol terciario tiende a ser más pesado, es más ramificado, y además es de todos el menos reactivo respecto a la oxidación; esto es, no puede transformarse en una cetona o ácido carboxílico como ocurre con los alcoholes secundarios y primarios, respectivamente.
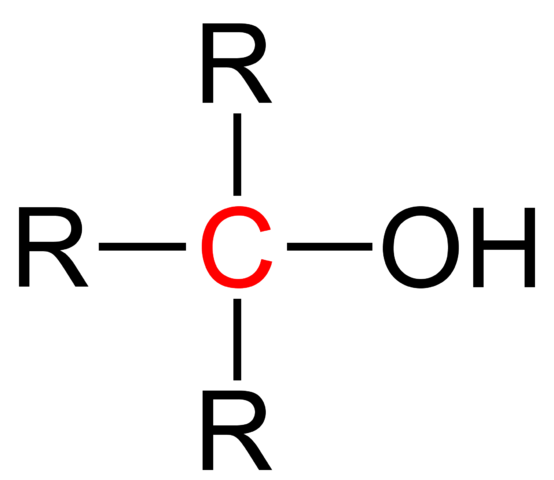
En la imagen superior se muestra la fórmula estructural general para un alcohol terciario. De acuerdo a ella, se pudiera escribir una nueva fórmula del tipo R3COH, donde R puede ser un grupo alquilo o arilo; un grupo metilo, CH3, o una cadena carbonada corta o larga.
Si los tres grupos R son diferentes, el carbono central del alcohol terciario será quiral; es decir, el alcohol presentará actividad óptica. Por este hecho los alcoholes terciarios quirales cobran interés dentro de la industria farmacéutica, pues a partir de cetonas con actividad biológica se sintetizan estos alcoholes con estructuras más complejas.
Índice del artículo
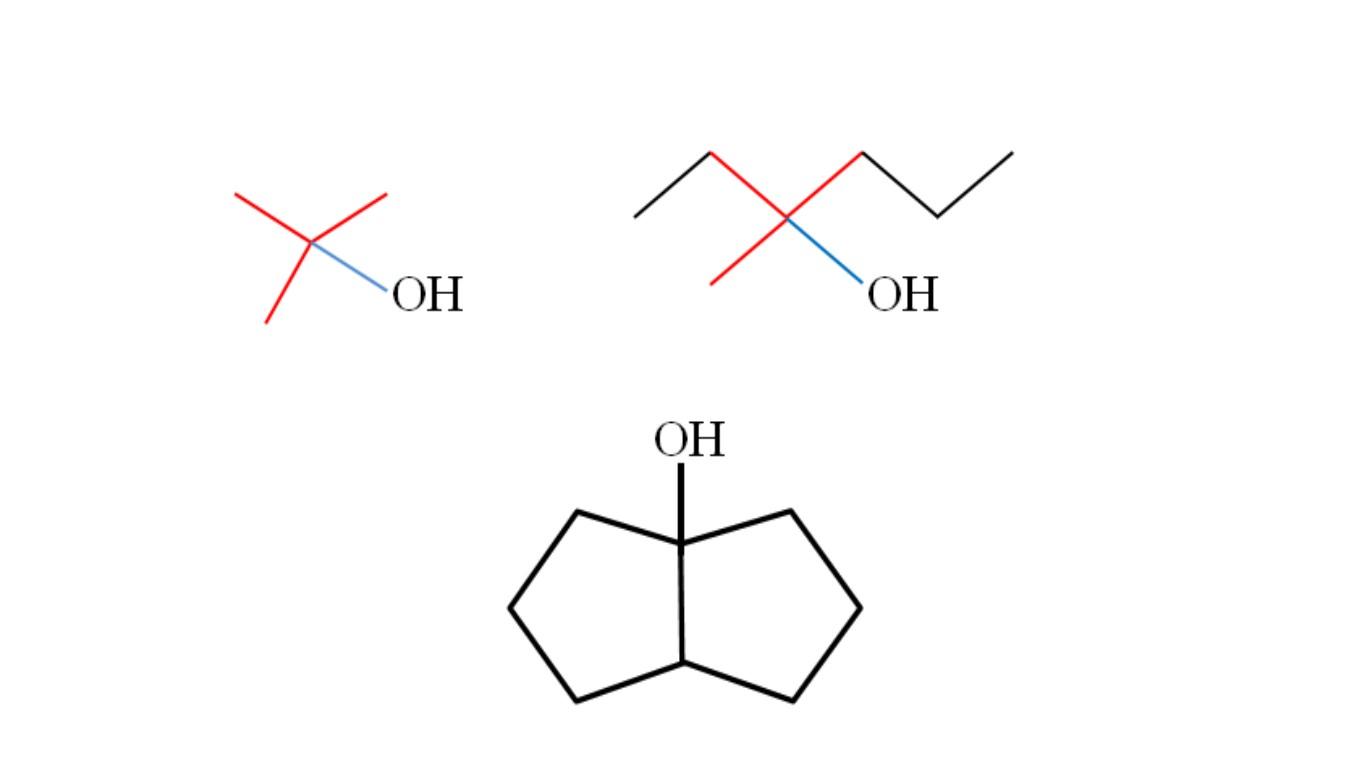
Considere las estructuras de los alcoholes terciarios superiores para aprender a reconocerlos sin importar cuál sea el compuesto. El carbono enlazado al OH debe también estar enlazado a otros tres carbonos. Si se observa detalladamente, los tres alcoholes cumplen con esto.
El primer alcohol (en la izquierda), consiste de tres grupos CH3 enlazados al carbono central, cuya fórmula vendría a ser (CH3)3COH. El grupo alquilo (CH3)3C- se conoce como tertbutilo, está presente en muchos alcoholes terciarios y puede reconocerse fácilmente por su forma de T (la T roja de la imagen).
El segundo alcohol (en la derecha), tiene enlazado al carbono central los grupos CH3, CH3CH2 y CH2CH2CH3. Como los tres grupos son diferentes, el alcohol es quiral y exhibe por ende actividad óptica. Aquí no se observa una T, sino una X cercano al OH (de color rojo y azul).
Y en el tercer alcohol (el de abajo y sin colores), el OH está enlazado a uno de los dos carbonos que unen dos ciclopentano. Este alcohol no presenta actividad óptica porque dos de los grupos enlazados al carbono central son idénticos. Al igual que el segundo alcohol, si se observa cuidadosamente se hallará también una X (más bien un tetraedro).
Los tres alcoholes superiores tienen algo más en común que una X: el carbono central se encuentra impedido estéricamente; esto es, hay muchos átomos rodeándole en el espacio. Una consecuencia inmediata de esto es que los nucleófilos, ávidos por cargas positivas, consiguen dificultades para aproximarse a este carbono.
Por otro lado, al haber tres carbonos enlazados al carbono central, le donan parte de la densidad electrónica que le sustrae el átomo electronegativo del oxígeno, estabilizándolo aún más frente a estos ataques nucleofílicos. No obstante, el alcohol terciario puede sufrir sustitución mediante la formación de un carbocatión.
Los alcoholes 3º presentan generalmente estructuras altamente ramificadas. Una primera consecuencia de esto es que el grupo OH se encuentra impedido, y por lo tanto, su momento dipolar ejerce un efecto menor sobre las moléculas vecinas.
Esto se traduce en interacciones moleculares más débiles en comparación a las de los alcoholes primarios y secundarios.
Por ejemplo, considérese los isómeros estructurales del butanol:
CH3CH2CH2OH (n-butanol, Peb = 117ºC)
(CH3)2CH2OH (alcohol isobutílico, peb = 107ºC)
CH3CH2CH(OH)CH3 (alcohol secbutílico, peb = 98ºC)
(CH3)3COH (alcohol tertbutílico, peb = 82ºC)
Nótese cómo descienden los puntos de ebullición a medida que el isómero se torna más ramificado.
Al principio se mencionó que en las estructuras de los alcoholes 3º se observan una X, la cual de por sí indica una alta ramificación. Es por eso que estos alcoholes tienden a tener puntos de fusión y/o ebullición menores.
Ligeramente similar es el caso para su miscibilidad con el agua. Mientras más impedido esté el OH menos miscible será el alcohol 3º con el agua. Sin embargo, dicha miscibilidad disminuye cuanto más larga sea la cadena carbonada; siendo así, el alcohol terbutílico es más soluble y miscible con el agua que el n-butanol.
Los alcoholes terciarios tienden a ser los menos ácidos de todos. Las razones son numerosas y se relacionan entre sí. En resumidas cuentas, la carga negativa de su alcóxido derivado, RO–, sentirá una fuerte repulsión por los tres grupos alquilos enlazados al carbono central, debilitando al anión.
Mientras más inestable sea el anión, menor será la acidez del alcohol.
Los alcoholes 3º no pueden sufrir oxidaciones a cetonas (R2C=O) ni a aldehídos (RCHO) o ácidos carboxílicos (RCOOH). Por un lado, tendría que perder uno o dos carbonos (en forma de CO2) para oxidarse, lo cual disminuye su reactividad frente a la oxidación; y por el otro, carece de hidrógeno que pueda perder para formar otro enlace con el oxígeno.
No obstante, sí pueden sufrir sustitución y eliminación (formación de un doble enlace, un alqueno u olefina).
La nomenclatura para estos alcoholes no es diferente que la de los demás. Existen nombres comunes o tradicionales, y los nombres sistemáticos regidos por la IUPAC.
Si la cadena principal y sus ramificaciones consisten de un grupo alquilo reconocido, este se utiliza para su nombre tradicional; cuando no es posible hacerlo, se recurre a la nomenclatura IUPAC.
Por ejemplo, considere el siguiente alcohol terciario:
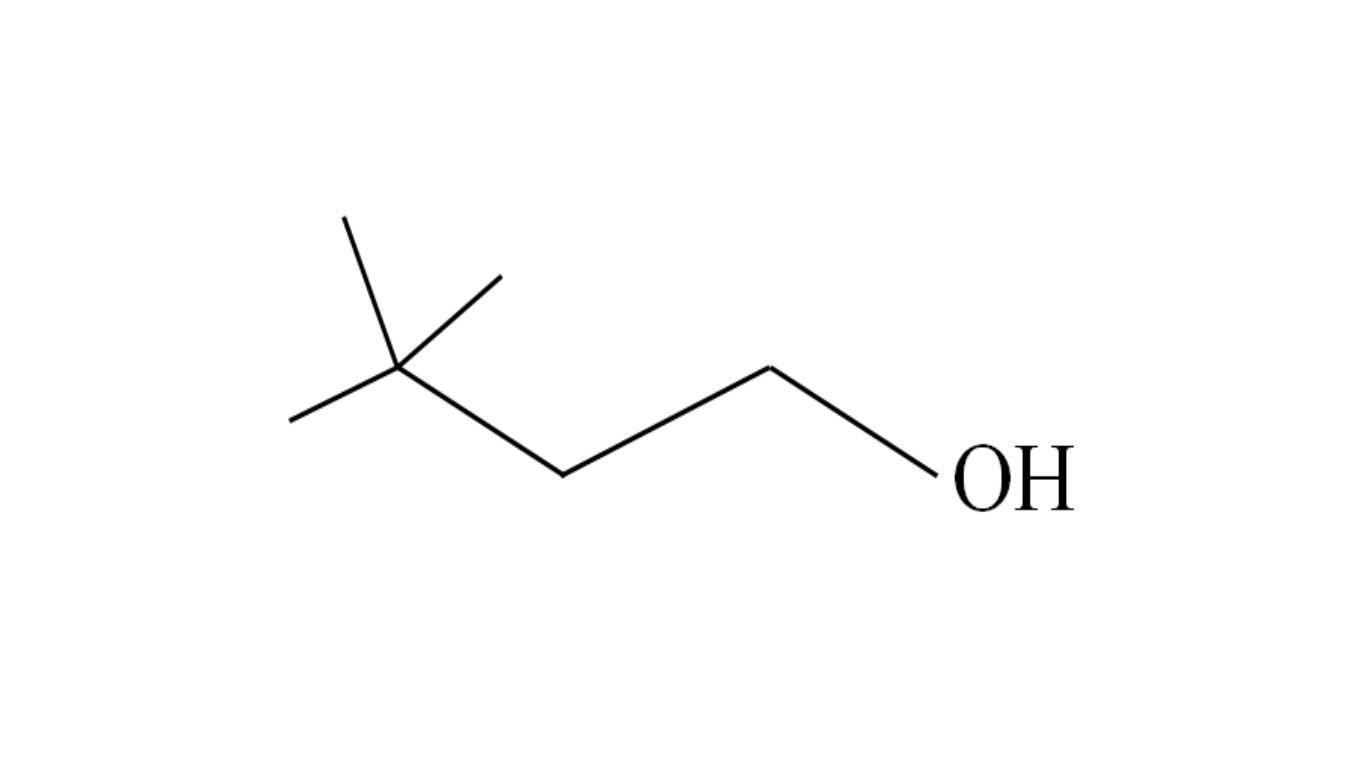
Se empieza a enumerar los carbonos de derecha a izquierda. En el C-3 hay dos grupos CH3 de sustituyentes, y por tanto el nombre de este alcohol es 3,3-dimetil-1-butanol (la cadena principal tiene cuatro carbonos).
Asimismo, toda la cadena y sus ramificaciones consisten del grupo neohexilo; por lo tanto, su nombre tradicional puede ser alcohol neohexílico, o neohexanol.
Para finalizar se mencionan algunos ejemplos de alcoholes terciarios:
-2-metil-2-propanol
-3-metil-3-hexanol
-Biciclo [3,3,0] octan-1-ol
-2-metil-2-butanol: CH3CH2COH(CH3)2
Las fórmulas de los primeros tres alcoholes están representadas en la primera imagen.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. (5ta Edición). Editorial Addison-Wesley Interamericana.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Gunawardena Gamini. (31 de enero de 2016). Tertiary alcohol. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Ashenhurst James. (16 de junio de 2010). Alcohols (1) – Nomenclature and Properties. Recuperado de: masterorganicchemistry.com
- Clark J. (2015). Introducing alcohols. Recuperado de: chemguide.co.uk
- Química Orgánica. (s.f.). Tema 3. Alcoholes. [PDF]. Recuperado de: sinorg.uji.es
- Nilanjana Majumdar. (03 de marzo de 2019). Synthesis of Chiral Tertiary Alcohol: Significant Developments. Recuperado de: 2.chemistry.msu.edu
