Alcohol isoamílico: estructura, propiedades, usos y riesgos
El alcohol isoamílico es un compuesto orgánico cuya fórmula es (CH3)2CHCH2CH2OH. Químicamente hablando es un alcohol primario ramificado, y constituye uno de los isómeros del pentanol, llamados alcoholes amílicos (C5H12O).
Al igual que muchos alcoholes de bajo peso molecular, es un líquido incoloro a temperatura ambiente. Esto permite y facilita que se utilice como solvente para distintas aplicaciones; más aún, cuando no ejerce demasiados efectos negativos en el ecosistema tras desecharse.
Si bien es un material intermediario en la síntesis del acetato de amilo para la elaboración de fragancias artificiales de plátano, su olor propio es desagradable y parecido al de las peras.
Además de servir como solvente de múltiples sustancias biológicas, y como intermediario en la síntesis de otros acetatos, reduce la tensión superficial de ciertas formulaciones industriales, evitando que se formen espumas. Por lo tanto, se usa en sistemas microemulsionados.
Respecto a su procedencia natural, se ha encontrado el alcohol isoamílico en las feromonas de los avispones, y en las trufas negras, un tipo de hongos ubicado en el sureste europeo.
Índice del artículo
- 1 Estructura del alcohol isoamílico
- 2 Propiedades
- 2.1 Apariencia física
- 2.2 Olor y sabor
- 2.3 Masa molar
- 2.4 Densidad
- 2.5 Densidad de vapor
- 2.6 Presión de vapor
- 2.7 Punto de ebullición
- 2.8 Punto de fusión
- 2.9 Punto de ignición
- 2.10 Temperatura de autoignición
- 2.11 Solubilidad
- 2.12 Viscosidad
- 2.13 Tensión superficial
- 2.14 Índice de refracción
- 2.15 Capacidad calorífica
- 3 Usos
- 4 Riesgos
- 5 Referencias
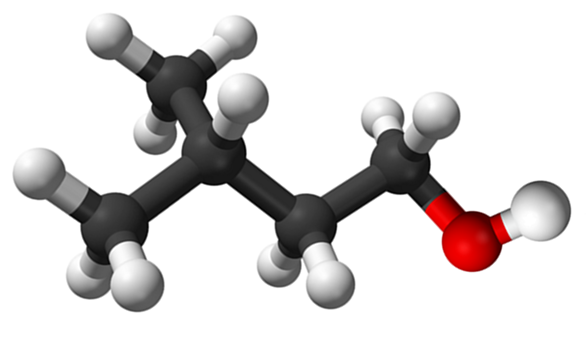
En la imagen superior se mostró la molécula del alcohol isoamílico representada con un modelo de esferas y barras. A la derecha de la misma, la esfera rojiza corresponde al átomo de oxígeno del grupo OH, característico para todos los alcoholes; mientras que a la izquierda, está el esqueleto carbonado con un grupo metilo, CH3, ramificando la estructura.
Desde un punto de vista molecular, este compuesto es dinámico por tener átomos con hibridaciones sp3, facilitando la rotación de sus enlaces; siempre y cuando no provoque que se eclipsen el OH y CH3.
También cabe mencionar su característica anfifílica: tiene un extremo apolar o hidrofóbico, constituido por la cadena (CH3)2CHCH2CH2-, y una cabeza polar o hidrofílica, el grupo OH. Esta definición de dos áreas concretas de distintas polaridades hacen de este alcohol un tensoactivo; y de aquí se debe su aplicación para las microemulsiones.
Dada la presencia del grupo OH, la molécula de alcohol isoamílico presenta un momento dipolar permanente. En consecuencia, las fuerzas dipolo-dipolo logran cohesionar sus moléculas, responsables de las propiedades físicas y mesurables del líquido, al igual que su olor.
Si bien la ramificación de las cadenas principales disminuye las interacciones efectivas entre las moléculas, los puentes de hidrógeno en este alcohol compensan este descenso, haciendo que el líquido hierva a 131°C, temperatura superior a la del punto de ebullición del agua.
No igual sucede con su sólido o “hielo”, el cual funde a -117°C, indicativo de que sus interacciones intermoleculares no son lo suficientemente fuertes para mantener ordenadas sus moléculas; en especial, si el grupo CH3 que ramifica la cadena principal impide un mejor contacto entre las moléculas.
Líquido incoloro.
Despide un olor desagradable parecido al de la pera, y tiene un sabor punzante.
88,148 g/mol.
0,8104 g/mL a 20°C. Es por lo tanto menos denso que el agua.
Es 3,04 veces más denso que el aire.
2,37 mmHg a 25°C.
131,1°C.
-117,2°C.
43°C (copa cerrada).
340°C.
Es relativamente soluble en agua: 28g/L. Esto se debe a que las moléculas altamente polares del agua no sienten especial afinidad por la cadena carbonada del alcohol isoamílico. Si se mezclaran, se observarían dos fases: una inferior, correspondiente al agua, y una superior, la del alcohol isoamílico.
En contraste, es mucho más soluble en solventes menos polares tales como: acetona, dietil éter, cloroformo, etanol, o ácido acético glacial; e inclusive, en éter de petróleo.
3,738 cP a 25°C.
24,77 dinas/cm a 15°C.
1,4075 a 20°C.
2,382 kJ/g·K.
A partir del alcohol isoamílico pueden sintetizarse otros ésteres, tiofeno, y fármacos tales como nitrito de amilo, Validol (mentil isovalerato), Bromisoval (bromovalerilurea), Corvalol (un tranquilizante de valeriana) y Barbamil (amobarbital).
Además de utilizarse para la síntesis del acetato de amilo, el cual tiene un aroma de plátano, también de él se obtienen otras fragancias frutales como el albaricoque, naranjas, ciruela, cereza y malta. Por lo tanto, es un alcohol necesario en la elaboración de numerosos productos comestibles o cosméticos.
Al reducir la tensión superficial promueve su uso en los sistemas microemulsionados. Prácticamente, evita la formación acelerada de burbujas, reduciéndolas de tamaño hasta romperlas.
Asimismo, ayuda a definir mejor la interfaz entre las fases acuosa y orgánica durante las extracciones; por ejemplo, se adiciona a la mezcla extractora fenol-cloroformo en una proporción 25:24:1. Esta técnica se destina para la extracción de ADN.
El alcohol isoamílico también permite extraer las grasas o aceites de diferentes muestras, por ejemplo, de la leche. Asimismo, disuelve la cera de parafina, tintas, gomas, lacas y ésteres de celulosa.
Siguiendo con las extracciones, con él se puede obtener el ácido fosfórico a partir de disoluciones de nitratos de minerales fosfáticos de hierro.
Como todo líquido que desprende olores, puede representar un riesgo inminente de incendio si el lugar donde se almacena eleva demasiado su temperatura, más aún si ya hay una fuente de calor.
En estas condiciones, actúa sencillamente como un combustible, alimentando las llamas y llegando incluso a explotar su contenedor. Al arder, libera vapores que pueden afectar a la salud y provocar asfixia.
Otras causas de que se incendie el alcohol isoamílico es mezclarlo o hacerlo reaccionar con sustancias tales como: percloratos, peróxidos, bromo, flúor, hidruros metálicos, ácidos fuertes, aminas alifáticas, etc.
Al contacto con la piel puede irritarla y resecarla. Los síntomas, sin embargo, son más graves si se inhala durante demasiado tiempo (tos, quemaduras en la nariz, garganta y pulmones), o si se ingiere (dolor de cabeza, náuseas, diarrea, vómitos, mareos y pérdida del conocimiento).
Y finalmente, cuando se derrama en los ojos los irrita y puede incluso dañarlos irreversiblemente. Por suerte, su olor a “peras alcohólicas” permite detectarlo en caso de fuga o derrame; además de esto, es un compuesto que debe manipularse con respeto.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Wikipedia. (2019). Isoamyl alcohol. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Isoamyl alcohol. PubChem Database. CID=31260. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Zhang Yu & Muhammed Mamoun. (17 de septiembre de 2008). Extraction of phosphoric acid from nitrate solutions with isoamyl alcohol. Solvent Extraction and Ion Exchange Volume 6, 1988 – Issue 6. doi.org/10.1080/07366298808917973
- New Jersey Department of Health. (2008). Isoamyl alcohol. [PDF]. Recuperado de: nj.gov
- Kat Chem. (2019). Isoamyl alcohol. Recuperado de: kat-chem.hu
- Chemoxy International Ltd. (s.f.). Isoamyl alcohol. Recuperado de: chemoxy.com
