Enlace covalente no polar: qué es, formación, características, ejemplos
¿Qué es un enlace covalente no polar?
Un enlace covalente no polar, también llamado enlace covalente puro o apolar, es la unión de dos átomos que comparten uno o más pares de electrones de forma equitativa. Es decir que los electrones que forman el enlace pasan aproximadamente la misma cantidad de tiempo cerca de uno de los átomos que del otro.
Este tipo de enlace se da entre dos átomos iguales (del mismo elemento) o entre dos átomos diferentes, pero que tengan electronegatividades muy similares.
Existen tres tipos de enlaces químicos que mantienen a los átomos unidos entre sí. Estos son: el enlace iónico, el enlace covalente y el enlace metálico. Estos enlaces se diferencian según cómo están repartidos los electrones en torno a los átomos.
En el caso de los enlaces covalentes, los dos átomos comparten los electrones de valencia, lo que quiere decir que estos electrones, en lugar de girar en torno a un átomo, giran en torno a los dos. Sin embargo, esto no siempre es equitativo, ya que los electrones prefieren pasar más tiempo cerca del átomo más electronegativo, dando origen a un enlace covalente polar.
En el caso de los enlaces covalentes no polares esto no sucede, ya que ambos átomos tienen la misma electronegatividad o electronegatividades muy similares.
Características del enlace covalente no polar
1. Se forman entre átomos con electronegatividades iguales o muy similares
Son enlaces covalentes que se forman entre átomos iguales o que tengan electronegatividades muy similares. En general, un enlace covalente se considera no polar si la diferencia de electronegatividades es menor o igual a 0,4.
2. Pueden ser simples, dobles o triples
Dependiendo del número de pares de electrones que comparten ambos átomos, los enlaces covalentes no polares o apolares pueden ser simples, dobles o triples.
Cuando el enlace está formado por un solo par de electrones, se denomina enlace simple, cuando se comparten dos pares de electrones se denomina enlace doble, y si se comparten tres pares de electrones se denomina enlace triple.
3. Casi siempre involucran no metales
Los metales son elementos con electronegatividades muy bajas que forman enlaces metálicos entre sí. Cuando se enlazan con los no metales, siempre forman bien sea enlaces iónicos o enlaces polares. Por esta razón, los enlaces covalentes no polares solo se forman entre elementos no metálicos tales como el hidrógeno y el carbono.
4. Dan origen a compuestos apolares
Un compuesto que solo posea enlaces covalentes no polares estará formado por moléculas apolares. Este tipo de compuestos se caracterizan por poseer puntos de ebullición y fusión bajos comparados con los metales y los compuestos iónicos (algunos incluso son gases a temperatura ambiente), son insolubles en agua y son malos conductores del calor y de la electricidad.
5. Pueden formar compuestos sólidos, líquidos o gaseosos a temperatura ambiente
Los compuestos con enlaces covalentes no polares pueden tener puntos de ebullición y fusión bajos pero muy variados.
Debido a esto, algunos de ellos son gases a temperatura ambiente (como el hidrógeno, H2, y el nitrógeno, N2), otros son líquidos (como el bromo, Br2), mientras que otros son sólidos (como el naftaleno, C10H8).
6. Poseen energías de enlace relativamente bajas.
Comparados con los enlaces iónicos, los enlaces covalentes no polares son más fáciles de romper, ya que tienen una menor energía de enlace. Esto quiere decir que hay que utilizar menos energía para romper un enlace covalente no polar que un enlace iónico.
Ejemplos de enlaces covalentes no polares
Enlace H-H en la molécula de hidrógeno (H2)
En la molécula de hidrógeno, H2, dos átomos de hidrógeno comparten sus únicos electrones de valencia para formar un enlace covalente simple.

Como ambos átomos son iguales, la diferencia de electronegatividades entre los dos será cero, por lo que este enlace es un enlace covalente no polar.
Enlace F-F en la molécula de flúor (F2)
Este ejemplo resalta el hecho de que no importa la electronegatividad de un átomo, sino la diferencia de electronegatividades de los dos átomos que forman un enlace para saber si el enlace será covalente no polar o no.

El flúor es el elemento más electronegativo de la tabla periódica, por lo que tiende a quitarle sus electrones a los demás elementos para formar enlaces polares o iónicos.
Sin embargo, cuando un átomo de flúor se enlaza a otro igual a él, ninguno de los dos le puede quitar los electrones al otro (no hay diferencia de electronegatividad), así que no les queda más remedio que compartirlos equitativamente y formar, así, un enlace covalente no polar.
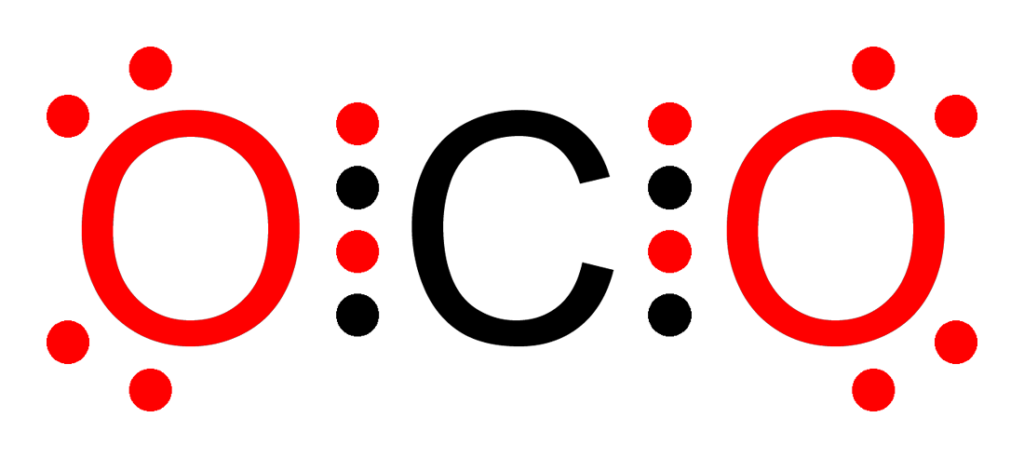
Los enlaces O-O en la molécula de ozono (O3)
Al igual que en el caso de la molécula de flúor, el oxígeno también es un elemento muy electronegativo. Sin embargo, al formar enlaces con otros átomos de oxígeno, forma enlaces covalentes no polares. Tal es el caso de la molécula de ozono.

En este caso, el átomo central de oxígeno está enlazado a otros dos átomos de oxígeno por medio de enlaces covalentes no polares o apolares.
Enlace N-N en la molécula de nitrógeno (N2)
La molécula de nitrógeno contiene un enlace covalente no polar, en el cual cada átomo de nitrógeno comparte sus tres electrones de valencia desapareados con el otro.

Por esta razón, ambos átomos comparten un total de tres pares de electrones, formando así un enlace covalente triple.
Enlaces C-H en la molécula de metano (CH4)
El metano es un ejemplo de un enlace covalente no polar formado entre átomos de elementos diferentes, en este caso, carbono e hidrógeno.
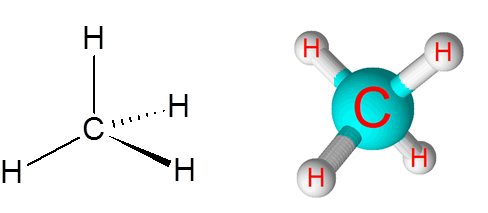
La diferencia de electronegatividad entre ambos elementos es de 0,4 lo que coloca a este enlace justo en la frontera entre los enlaces no polares y polares.
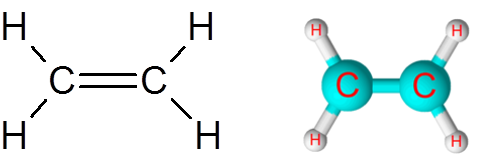
Enlace C=C en la molécula de etileno (C2H4)
La molécula de etileno, también llamado eteno, posee en total cinco enlaces. Cuatro enlaces C-H y un enlace doble C=C. En ambos casos, los enlaces corresponden a enlaces covalentes no polares o apolares.