Filamentos intermedios: estructura, tipos, funciones
Los filamentos intermedios, también conocidos en la literatura como “IFs” (del inglés Intermediate filaments), son una familia de proteínas fibrosas citosólicas insolubles que están presentes en todas las células de los eucariotas multicelulares.
Forman parte del citoesqueleto, que es una red filamentosa intracelular que se encarga, principalmente, del soporte de la estructura celular y de diversos procesos metabólicos y fisiológicos como el transporte de vesículas, el movimiento y desplazamiento celular, etc.
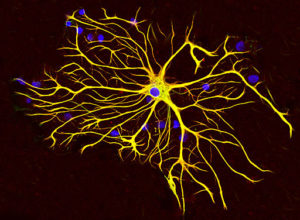
Junto con los microtúbulos y los microfilamentos, los filamentos intermedios participan en la organización espacial de los orgánulos intracelulares, en los procesos de endocitosis y exocitosis y también en los procesos de división celular y comunicación intercelular.
Los primeros filamentos intermedios que fueron estudiados y descritos fueron las queratinas, uno de los primeros tipos de proteínas cuya estructura fue analizada por difracción de rayos X en la década de 1930.
El concepto de filamentos intermedios, sin embargo, fue introducido en la década de 1980 por Lazarides, quien los describió como complejos “integradores mecánicos del espacio celular”, caracterizados por su insolubilidad y su capacidad de reensamblarse in vitro después de su desnaturalización.
Muchos autores los consideran los elementos de “amortiguación” del estrés para las células animales, dado que son filamentos más flexibles que los microtúbulos y los microfilamentos. No sólo se encuentran en el citoesqueleto, sino que también forman parte del nucleoesqueleto.
A diferencia de los otros componentes fibrosos del citoesqueleto, los filamentos intermedios no participan directamente en los procesos de movilidad celular, sino que funcionan en el mantenimiento estructural y la resistencia mecánica de las células.
Índice del artículo
- 1 Estructura
- 2 Ensamblaje
- 3 Funciones
- 4 Tipos de filamentos intermedios
- 4.1 Clase I y II de filamentos intermedios: queratinas ácidas y básicas
- 4.2 Clase III de filamentos intermedios: Proteínas tipo desmina/vimentina
- 4.3 Clase IV de filamentos intermedios: proteínas neurofilamentosas
- 4.4 Clase V de filamentos intermedios: filamentos de la lámina nuclear
- 4.5 Clase VI de filamentos intermedios: Nestinas
- 5 Patologías relacionadas
- 6 Referencias
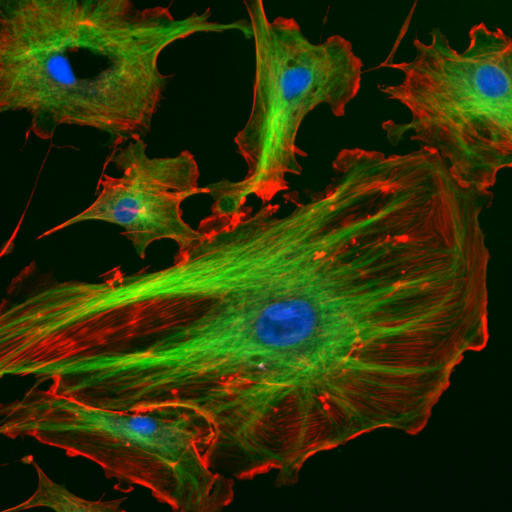
Los filamentos intermedios tienen un diámetro aproximado de 10 nm, característica estructural por la cual fueron nombrados, puesto que su tamaño se encuentra entre los tamaños correspondientes a los filamentos de miosina y los de actina, que rondan entre los 25 nm y los 7 nm, respectivamente.
Se diferencian estructuralmente de los otros dos tipos de filamentos del citoesqueleto, que son polímeros de proteínas globulares, en que sus unidades constitutivas son distintas proteínas fibrosas α-helicoidales de gran longitud que se agrupan entre sí para formar estructuras en forma de soga o cuerda.
Todas las proteínas que constituyen a los filamentos intermedios poseen una organización molecular semejante, que consiste en un dominio α-helicoidal o de “cuerda” que posee diferentes cantidades de segmentos “formadores de bobinas” del mismo tamaño.
Este dominio helicoidal está flanqueado por una “cabeza” no helicoidal N-terminal y una “cola” no helicoidal en el extremo C-terminal, y ambas varían tanto en tamaño como en secuencia aminoacídica.
Dentro de la secuencia de estos dos extremos se encuentran los motivos consenso que son comunes para los 6 tipos de filamentos intermedios conocidos.
En los vertebrados, el dominio de “cuerda” de las proteínas de los filamentos intermedios citosólicos tiene alrededor de 310 residuos aminoacídicos, mientras que las proteínas citosólicas de los invertebrados y de la lámina nuclear tienen más o menos 350 aminoácidos de longitud.
Los filamentos intermedios son estructuras “autoensamblables” que no poseen actividad enzimática, lo que también las diferencia de sus contrapartes citoesqueléticas (microtúbulos y microfilamentos).
Estas estructuras se ensamblan inicialmente como tetrámeros de las proteínas filamentosas que los conforman bajo la influencia, únicamente, de cationes monovalentes.
Estos tetrámeros tienen 62 nm de longitud y sus monómeros se asocian entre sí lateralmente para formar las “unidades de longitud” (UFL, del inglés unit-length filaments), lo que se conoce como la fase 1 del ensamblaje, que ocurre con gran rapidez.
Las UFLs son los precursores de los filamentos largos y, dado que los dímeros que los conforman se unen entre sí de forma antiparalela y escalonada, estas unidades poseen un dominio central con dos dominios flanqueantes a través de los cuales ocurre la fase 2 de la elongación, donde se da la unión longitudinal de otros UFLs.
Durante lo que se ha denominado como la fase 3 del ensamblaje, ocurre la compactación radial del diámetro de los filamentos, lo que produce a los filamentos intermedios maduros de más o menos 10 nm de diámetro.
Las funciones de los filamentos intermedios dependen considerablemente del tipo de célula que se considere y, en el caso de los animales (incluyendo a los seres humanos), su expresión es regulada de forma tejido-específica, por lo que también depende del tipo de tejido que en estudio.
Los epitelios, músculos, células mesenquimales y gliales y neuronas poseen tipos de filamentos diferentes, especializados de acuerdo con la función de las células a las que pertenecen.
Entre dichas funciones, las más importantes son el mantenimiento estructural de las células y la resistencia a distintos de estrés mecánicos, puesto que estas estructuras poseen cierta elasticidad que les permite amortiguar diferentes tipos de fuerzas impuestas sobre las células.
Las proteínas que constituyen a los filamentos intermedios pertenecen a una numerosa y heterogénea familia de proteínas filamentosas que son químicamente diferentes pero que se distinguen en seis clases según su homología de secuencias (I, II, III, IV, V y VI).
Aunque no es muy común, distintos tipos de células, bajo condiciones muy particulares (desarrollo, transformación celular, crecimiento, etc.) pueden co-expresar más de una clase de proteínas formadoras de filamentos intermedios
Las queratinas representan la mayor parte de las proteínas de los filamentos intermedios y, en los humanos, estas representan más de las tres cuartas partes de los filamentos intermedios.
Tienen pesos moleculares que varían entre 40 y 70 kDa y se diferencian de otras proteínas de filamentos intermedios por sus altos contenidos en residuos de glicina y serina.
Se conocen como queratinas ácidas y básicas por sus puntos isoeléctricos, que rondan entre 4.9 y 5.4 para las queratinas acídicas y entre 6.1 y 7.8 para las básicas.
En estas dos clases se han descrito alrededor de 30 proteínas y están presentes especialmente en las células epiteliales, donde se ambos tipos de proteínas “co-polimerizan” y forman filamentos compuestos.
Muchas de las queratinas de la case I de filamentos intermedios se encuentran en estructuras como el pelo, las uñas, los cuernos, las púas y las garras, mientras que las de la clase II son las más abundantes en el citosol.
La desmina es una proteína acídica de 53 kDa que, dependiendo de su grado de fosforilación, posee distintas variantes.
Algunos autores también han denominado a los filamentos de desmina como “filamentos intermedios musculares”, puesto que su presencia está bastante restringida, aunque en pequeñas cantidades, a todos los tipos de células musculares.
En las miofibrillas, la desmina se encuentra en la línea Z, por lo que se piensa que esta proteína contribuye con las funciones contráctiles de las fibras musculares al funcionar en la unión de miofibrillas y membrana plasmática.
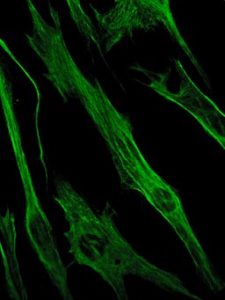
A su vez, la vimentina es una proteína presente en las células mesenquimales. Los filamentos intermedios formados por esta proteína son flexibles y se ha determinado que resisten a muchos de los cambios conformacionales que ocurren durante el ciclo celular.
Se encuentra en los fibroblastos, en las células del músculo liso, en los glóbulos blancos y en otras células del sistema circulatorio de los animales.
También conocidos como “neurofilamentos”, esta clase de filamentos intermedios comprende uno de los elementos estructurales fundamentales de los axones y las dendritas neuronales; a menudo se asocian con los microtúbulos que también conforman estas estructuras.
Los neurofilamentos de animales vertebrados han sido aislados, determinando que se trata de un triplete de proteínas de 200, 150 y 68 kDa que participan en el ensamblaje in vitro.
Se diferencian de otros filamentos intermedios en que poseen brazos laterales como “apéndices” que se proyectan desde la periferia de los mismos y que funcionan en la interacción entre filamentos vecinos y otras estructuras.
Las células gliales producen un tipo especial de filamentos intermedios conocidos como los filamentos intermedios gliales, que difieren estructuralmente de los neurofilamentos, puesto que están compuestos por una sola proteína de 51 kDa y que tiene propiedades fisicoquímicas diferentes.
Todas las láminas que forman parte del nucleoesqueleto son, en realidad, proteínas de filamentos intermedios. Estas tienen entre 60 y 75 kDa de peso molecular y se encuentran en los núcleos de todas las células eucariotas.
Son esenciales para la organización interna de las regiones nucleares y para muchas de las funciones propias de este orgánulo esencial para la existencia de los eucariotas.
Este tipo de filamentos intermedios pesa más o menos 200 kDa y se encuentra predominantemente en las células madre del sistema nervioso central. Se expresan durante el desarrollo neuronal.
Existen múltiples enfermedades en los seres humanos que se relacionan con los filamentos intermedios.
En algunos tipos de cáncer como los melanomas malignos o los carcinomas de seno, por ejemplo, la co-expresión de filamentos intermedios de vimentina y queratina conllevan a la diferenciación o interconversión de células epiteliales y mesenquimales.
Se ha demostrado experimentalmente que este fenómeno incrementa la actividad migratoria e invasiva de las células cancerosas, lo que tiene importantes implicaciones en los procesos metastásicos característicos de esta condición.
Eriksson y colaboradores (2009) revisan los distintos tipos de enfermedades y su relación con mutaciones específicas en los genes implicados en la formación de los seis tipos de filamentos intermedios.
Las enfermedades relacionadas con las mutaciones de los genes codificantes para los dos tipos de queratina son la epidermólisis bullosa, la hiperqueratosis epidermolítica, distrofia corneal, queratodermias y muchas otras.
Los filamentos intermedios de tipo III están implicados en numerosas cardiomiopatías y en diferentes enfermedades musculares relacionadas principalmente con distrofias. Además, también son responsables de las cataratas dominantes y de algunos tipos de esclerosis.
Numerosos síndromes y desórdenes neurológicos se relacionan con los filamentos de tipo IV, como por ejemplo el Parkinson. Del mismo modo, defectos genéticos en los filamentos de tipo V y VI son responsables para el desarrollo de distintas enfermedades autosómicas y relacionadas con el funcionamiento del núcleo celular.
Ejemplo de estas son el síndrome de progeria de Hutchinson-Gilford, la distrofia muscular Emery-Dreifuss, entre otros.
- Anderton, B. H. (1981). Intermediate filaments: a family of homologous structures. Journal of Muscle Research and Cell Motility, 2(2), 141–166.
- Eriksson, J. E., Pallari, H., Robert, D., Eriksson, J. E., Dechat, T., Grin, B., … Goldman, R. D. (2009). Introducing intermediate filaments: from discovery to disease. The Journal of Clinical Investigation, 119(7), 1763–1771.
- Fuchs, E., & Weber, K. (1994). Intermediate Filaments: Structure, Dynamics, Function and Disease. Annu. Rev. Biochem., 63, 345–382.
- Hendrix, M. J. C., Seftor, E. A., Chu, Y. W., Trevor, K. T., & Seftor, R. E. B. (1996). Role of intermediate filaments in migration, invasion and metastasis. Cancer and Metastasis Reviews, 15(4), 507–525.
- Herrmann, H., & Aebi, U. (2004). Intermediate Filaments: Molecular Structure, Assembly Mechanism, and Integration into Functionally Distinct Intracellular Scaffolds. Annual Review of Biochemistry, 73(1), 749–789.
- Herrmann, H., & Aebi, U. (2016). Intermediate Filaments: Structure and Assembly. Cold Spring Harbor Perspectives in Biology, 8, 1–22.
- McLean, I., & Lane, B. (1995). Intermediate filaments in disease. Current Opinion in Cell Biology, 7(1), 118–125.
- Steinert, P., & Roop, D. (1988). Molecular and Cellular Biology of Intermediate Filaments. Annual Review of Biochemistry, 57(1), 593–625.
- Steinert, P., Jones, J., & Goldman, R. (1984). Intermediate filaments. The Journal of Cell Biology, 99(1), 1–6.
