Hidruro de potasio: estructura, formación, propiedades
El hidruro de potasio (KH) es un compuesto químico de tipo iónico formado por la combinación directa del hidrógeno en su forma molecular y el metal alcalino potasio. Como todos los demás hidruros de este tipo, es un compuesto sólido, el cual posee un elevado punto de fusión como ocurre con todas las moléculas iónicas.
Los hidruros son compuestos químicos formados por hidrógeno y uno o más elementos distintos, de naturaleza metálica o no metálica. Según su estructura y características estas sustancias pueden ser de tres clases: hidruros iónicos, covalentes o intersticiales.
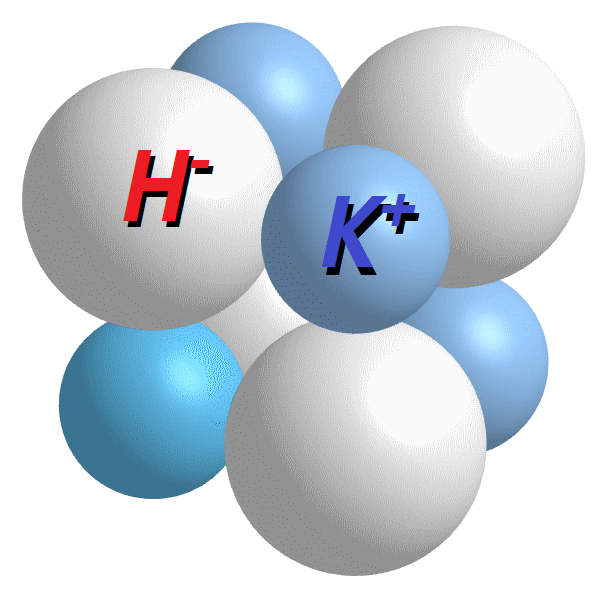
Al poseer la naturaleza de un compuesto iónico, el hidruro de potasio está constituido por un anión (en este caso, el ion hidruro H–) y un catión (el ion potasio K+).
El ion hidruro se comporta como una fuerte base de Brønsted; es decir, adopta fácilmente los protones de una sustancia donadora como el potasio metálico, que los recibe.
Índice del artículo
El potasio fue identificado por primera vez de manera experimental en el año 1807 por el químico británico sir Humphry Davy, así como otros elementos químicos (calcio, magnesio, boro, estroncio y bario) mediante la técnica de electrólisis.
También este científico fue quien descubrió la reacción química que da como resultado la formación del hidruro de potasio, el cual se presenta en su forma pura como un sólido de color blanco, aunque los reactivos que se consiguen de manera comercial son de color gris.
La estructura de este hidruro binario está caracterizada por ser cristalina, específicamente del tipo cúbica, es decir, la celda unitaria de este cristal es un cubo centrado en las caras, como se observa en la figura anterior.
Las reacciones llevadas a cabo por los hidruros metálicos se presentan en la superficie cristalina, y este hidruro ha manifestado poseer el radio de hidruro y la energía reticular óptima para este tipo de reacciones, incluso por encima de los hidruros de otros metales.
El hidruro de potasio, cuya fórmula se representa como KH, es una sustancia inorgánica que se clasifica como hidruro de metal alcalino debido a que se forma mediante la combinación de manera directa del hidrógeno molecular con el potasio a través de la siguiente reacción:
H2 + 2K → 2KH
Esta reacción fue descubierta por el mismo científico que identificó el potasio por primera vez. Se dio cuenta de cómo se vaporizaba este metal al estar expuesto a una corriente de gas hidrógeno, cuando se aumenta la temperatura de este por debajo de su punto de ebullición.
También se puede producir un hidruro de potasio que posea una actividad superior de una manera sencilla, partiendo de una reacción de hidrógeno y otros compuestos de carácter superbásico (como el tert-butóxido de potasio, llamado t-BuOK-TMEDA), y siendo preparado en hexano.
El hidruro de potasio no se encuentra de manera espontánea en la naturaleza. Se produce a partir de la reacción anteriormente descrita y se halla como un sólido cristalino, el cual se descompone a una temperatura alrededor de 400 °C, antes de alcanzar su punto de fusión.
Este compuesto posee una masa molar de aproximadamente 40,106 g/mol debido a la combinación de las masas molares de sus dos componentes. Además, su densidad es de 1,43 g/cm3 (tomando como punto de referencia la del agua en condiciones estándar, la cual es 1,00 g/cm3).
En este sentido, también se conoce que este compuesto tiene propiedades pirofóricas; es decir, que puede inflamarse de manera espontánea en la presencia de aire, así como de agentes oxidantes y de ciertos gases.
Por esta razón se debe tratar con precaución y contenerse como suspensión en un aceite de tipo mineral o incluso cera de parafina, así disminuye su piroforicidad y se facilita su manejo.
En cuanto a su solubilidad, este hidruro se considera soluble en hidróxidos fundidos (como el hidróxido de sodio fusionado), así como en mezclas salinas. En cambio, es insoluble en solventes de origen orgánico como dietiléter, benceno o disulfuro de carbono.
Del mismo modo, se considera una sustancia bastante corrosiva, la cual también manifiesta una reacción violenta cuando se pone en contacto con compuestos de naturaleza ácida, interactuando en relación cuantatitiva.
Esta especie también se comporta como una “superbase” considerada aun más fuerte que el compuesto hidruro de sodio; además, posee carácter de donador de iones hidruro.
El hidruro de potasio que se encuentra disponible de manera comercial, formado a través de la reacción de hidrógeno molecular con potasio elemental, posee una reactividad que está relacionada con las impurezas que posea (primordialmente potasio o sus productos de reacción), lo cual conlleva a reacciones secundarias y rendimientos que pueden variar.
Su naturaleza de basicidad extrema hace que sea de mucha utilidad para llevar a cabo ciertas síntesis orgánicas, así como en procesos de desprotonación de determinadas sustancias que poseen grupos carbonilo para dar origen a compuestos enolato.
Asimismo, el hidruro de potasio se utiliza en la transformación de ciertas aminas en sus amidas correspondientes (amidas con cadenas alquílicas del tipo KNHR y KNR2), por medio de su desprotonación. De igual manera, lleva a cabo una rápida desprotonación en alcoholes terciarios.
Así como es un excelente desprotonador, este compuesto también se emplea en algunas reacciones de eliminación, ciclación-condensación y rearreglo molecular, y constituye un excelente agente reductor.
En otro tipo de reacciones, un éter de corona puede desempeñarse como un agente de transferencia de fase, aunque también puede actuar como un simple agente de “decapado” (proceso para eliminar impurezas) de la superficie del hidruro de potasio, a través de la disolución de las sales inorgánicas que se forman.
- Chang, R. (2007). Chemistry. Mexico: McGraw-Hill
- Brown, C. A. (1974). Potassium hydride, highly active new hydride reagent. Reactivity, applications, and techniques in organic and organometallic reactions. Revista The Journal of Organic Chemistry.
- MacDiarmid, A. G. (2009). Inorganic Syntheses. Obtenido de books.google.co.ve
- Majewski, M., y Snieckus, V. (2014). Science of Synthesis: Houben-Weyl Methods of Molecular Transformations. Obtenido de books.google.co.ve
