¿Cuáles son las leyes ponderales de la química? (Ejemplos)
Las leyes ponderales de la química son aquellas que han demostrado que las masas de las sustancias que reaccionan no lo hacen de manera arbitraria ni azarosa; sino manteniendo una constante proporción matemática de números enteros o submúltiplos de los mismos, en la que los átomos de los elementos no se crean ni se destruyen.
En tiempos pasados establecer estas leyes requirió de esfuerzos extraordinarios de razonamiento; porque si bien ahora parece demasiado evidente, antes ni siquiera se conocían las masas atómicas ni moleculares de los elementos o compuestos, respectivamente.

Ya que no se sabía cuánto exactamente equivalía un mol de átomos de cada elemento, los químicos de los siglos XVIII y XIX debieron basarse en las masas reaccionantes. De modo que las balanzas analíticas rudimentarias (imagen superior) fueron compañeras inseparables durante los cientos de experimentos necesarios para el asentamiento de las leyes ponderales.
Es por esta razón que cuando se estudian estas leyes de la química se tropieza con mediciones de masas a cada instante. Gracias a esto, extrapolando los resultados de los experimentos se descubrió que los compuestos químicos puros se forman siempre con la misma proporción másica de sus elementos constituyentes.
Índice del artículo
- 1 Ley de la conservación de la masa
- 2 Ley de las proporciones definidas
- 3 Ley de las proporciones múltiples o ley de Dalton
- 4 Ley de las proporciones recíprocas
- 5 Referencias
Esta ley dice que en una reacción química, la masa total de los reactivos es igual a la masa total de los productos; siempre y cuando, el sistema considerado sea cerrado y no haya intercambio de masa y energía con sus alrededores.
En una reacción química, las sustancias no desaparecen, sino que se transforman en otras sustancias de igual masa; de allí la célebre frase: “nada se crea, nada se destruye, todo se transforma”.
Históricamente, la ley de la conservación de la masa en una reacción química, fue propuesta primero en 1756 por Mikhail Lomonsov, quien mostró en su diario los resultados de sus experimentos.
Posteriormente en 1774, Antoine Levoisier, químico francés, presentó los resultados de sus experimentos que permitieron establecer esta; la cual, algunos la llaman también la Ley de Lavoisier.
En el tiempo de Lavoisier (1743-1794), existía la Teoría del Flogisto, según la cual los cuerpos tenían la capacidad de inflamarse o quemarse. Los experimentos de Lavoisier permitieron desechar esta teoría.
Lavoisier realizó numerosos experimentos de combustión de metales. Pesaba cuidosamente los materiales antes y después de su combustión en un recipiente cerrado, hallando que había una aparente ganancia de peso.
Pero Lavoiser, basado en el conocimiento que tenía del papel del oxígeno en la combustión, concluyó que la ganancia de peso en la combustión era debida a la incorporación del oxígeno al material en combustión. Había nacido el concepto de los óxidos metálicos.
Por lo tanto, la suma de las masas de los metales sometidos a combustión y del oxígeno permanecía inalterable. Esta conclusión permitió el establecimiento de la Ley de la conservación de la masa.
La ley de la Conservación de las Masas estableció la necesidad de balancear las ecuaciones químicas, garantizando que el número de todos los elementos que intervienen en una reacción química, tanto como reactivos o como productos, sea exactamente el mismo.
Este es un requisito imprescindible para la exactitud de los cálculos estequiométricos que se realicen.
Moles de agua
¿Cuántos moles de agua pueden producirse durante la combustión de 5 moles de metano en un exceso de oxígeno? Demuestre además que se cumple la ley de la conservación de la materia.
CH4 + 2 O2 => CO2 + 2 H2O
Observando la ecuación balanceada de la reacción, se concluye que 1 mol de metano produce 2 moles de agua.
El problema puede ser resuelto directamente con un planteamiento simple, ya que no tenemos 1 mol sino 5 moles de CH4:
Moles de agua = 5 moles de CH4· (2 moles de H2O / 1 mol de CH4)
= 10
Lo que equivaldría a 180 g de H2O. También se formó 5 mol o 220 g de CO2, lo que es igual a una masa total de 400 g de productos.
Siendo así, para que se cumpla la ley de la conservación de la materia debe reaccionar 400 g de reactivos; ni más, ni menos. De esos 400 g, 80 g corresponden a los 5 moles de CH4 (multiplicando por su masa molecular de 16 g/mol), y 320 g a los 10 moles de O2 (de igual modo por su masa molecular de 32 g/mol).
Combustión de una cinta de magnesio
Una cinta de magnesio de 1,50 g se quemó en un recipiente cerrado que contenía 0,80 g de oxígeno. Después de la combustión quedó en el recipiente 0,25 g de oxígeno. a) ¿Qué masa de oxígeno reaccionó? b) ¿Cuánto óxido de magnesio se formó?
La masa de oxígeno que reaccionó se obtiene mediante una diferencia simple.
Masa de oxígeno consumido = (masa inicial – masa residual) oxígeno
= 0,80 g – 0,25 g
= 0,55 g O2 (a)
Según la ley de la conservación de la masa,
Masa de óxido de magnesio = masa de magnesio + masa de oxígeno
= 1,50 g + 0,55 g
= 2,05 g MgO (b)
Joseph Louis Proust (1754-1826), químico francés, se dio cuenta que en una reacción química los elementos químicos reaccionan siempre en proporciones fijas de masas para formar un compuesto puro en específico; por lo tanto, su composición es constante, sin importar la fuente o procedencia, ni cómo se sintetiza.
Proust en 1799 enunció la ley de las proporciones definidas, la cual establece que: “Cuando dos o más elementos se combinan para formar un compuesto, lo hacen en una relación fija de masa”. Entonces, esta relación es fija y no depende de la estrategia seguida para la preparación del compuesto.
A esta ley también se le conoce como la ley de la composición constante, la cual señala que: “Todo compuesto químico en estado de pureza contiene siempre los mismos elementos, en una proporción constante de masa”.
El hierro (Fe) reacciona con el azufre (S) para formar sulfuro de hierro (FeS), se pueden señalar tres situaciones (1, 2 y 3):
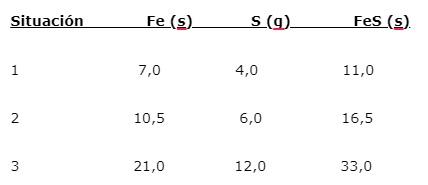
Para hallar la proporción en que se combinan los elementos, se divide la masa mayor (Fe) entre la masa menor (S). El cálculo da una proporción de 1,75:1. Este valor se repite en las tres condiciones dadas (1, 2 y 3), donde se obtiene la misma proporción aunque se utilizan masas diferentes.
Es decir que 1,75 g de Fe se combinan con 1,0 g de S para dar 2,75 g de FeS.
Mediante la aplicación esta ley, se puede conocer exactamente las masas de los elementos que deben combinarse para obtener una masa deseada de un compuesto.
De esta manera, puede obtenerse información acerca de la masa sobrante de alguno de los elementos que intervienen en una reacción química, o si existe un reactivo limitante en la reacción.
Además, se aplica para conocer la composición centesimal de un compuesto, y basándose en esta última, se puede establecer la fórmula de un compuesto.
Composición centesimal de un compuesto
El dióxido de carbono (CO2) es formado en la siguiente reacción:
C + O2 => CO2
12 g de carbono se combinan 32 g de oxígeno para dar 44 g de dióxido de carbono.
Entonces, el porcentaje de carbono es igual a
Porcentaje del carbono = (12 g / 44 g) · 100 %
= 27,3 %
Porcentaje de oxígeno = (32 g / 44 g) · 100 %
Porcentaje de oxígeno = 72,7 %
Usando el enunciado de la Ley de la Composición Constante, se puede señalar que el dióxido carbono siempre está formado por 27,3 % de carbono y 72,7 % de oxígeno.
Trióxido de azufre
Al hacer reaccionar en distintos recipientes 4 g y 6 g de azufre (S) con oxígeno (O), se obtuvieron, respectivamente, 10 g y 15 g de trióxido de azufre (SO3).
¿Por qué se obtuvieron tales cantidades de trióxido de azufre y no otras?
Calcule además la cantidad de azufre necesaria para combinarse con 36 g de oxígeno y la masa de trióxido de azufre obtenida.
Parte a)
En el primer recipiente se mezclan 4 de azufre con X g de oxígeno para obtener 10 g de trióxido. Si se aplica la ley de conservación de la masa, podemos despejar la masa de oxígeno que se combinó con el azufre.
Masa de oxígeno = 10 g de trióxido de oxígeno – 4 g de azufre.
= 6 g
En el recipiente 2 se mezclan 6 g de azufre con X g de oxígeno para obtener 15 de trióxido de azufre.
Masa de oxígeno = 15 g de trióxido de azufre – 6 g de azufre
= 9 g
Se procede entonces a calcular las proporciones O/S para cada recipiente:
Proporción O/S en la situación 1 = 6 g O / 4 g S
= 1,5 / 1
Proporción O/S en la situación 2 = 9 g O / 6 g S
= 1,5 / 1
Lo cual, está de acuerdo con lo planteado en la ley de las proporciones definidas que señala que los elementos siempre se combinan en la misma proporción para formar un determinado compuesto.
Por lo tanto, los valores obtenidos son correctos y los que corresponden a la aplicación de la Ley.
Parte b)
En la sección anterior se calculó un valor de 1,5 / 1 para la proporción O / S.
g de azufre = 36 de oxígeno · (1 g de azufre / 1,5 g de oxígeno)
= 24 g
g de trióxido de azufre = 36 g de oxígeno + 24 g de azufre
= 60 g
Cloro y magnesio
El cloro y el magnesio se combinan en la proporción de 2,95 g de cloro por cada g de magnesio. a) Determine las masas de cloro y de magnesio necesarias para obtener 25 g de cloruro de magnesio. b) ¿Cuál es composición porcentual del cloruro de magnesio?
Parte a)
Basándose en el valor 2,95 para la relación Cl:Mg, se puede hacer el planteamiento siguiente:
2,95 g de Cl + 1 g de Mg => 3,95 g de MgCl2
Luego:
g de Cl = 25 g de MgCl2 · (2,95 g Cl / 3,95 g MgCl2)
= 18,67
g de Mg = 25 g de MgCl2 · (1 g Mg / 3,95 g MgCl2)
= 6,33
Entonces, 18,67 g de cloro se combinan con 6,33 g de magnesio para producir 25 g de cloruro de magnesio.
Parte b)
Se calcula primero la masa molecular del cloruro de magnesio, MgCl2:
Peso molecular MgCl2 = 24,3 g/mol + (2 · 35,5 g/mol)
= 95,3 g/mol
Porcentaje de magnesio = (24,3 g / 95,3 g) x 100 %
= 25,5 %
Porcentaje de cloro = (71 g / 95,3 g) x 100 %
= 74,5 %
La Ley fue enunciada en 1803 por el químico y meteorólogo francés John Dalton, basándose en sus observaciones respecto a las reacciones de los gases atmosféricos.
La ley fue enunciada en la forma siguiente: “Cuando elementos se combinan para dar más de un compuesto, una masa variable de uno de ellos se une a una masa fija del otro y la primera tiene como relación de números canónigos e indistintos”.
También: “Cuando dos elementos se combinan para originar diferentes compuestos, dada una cantidad fija de uno de ellos, las diferentes cantidades del otro elemento que se combinan con dicha cantidad fija para producir los compuestos, están en relación de números enteros sencillos”.
John Dalton realizó la primera descripción moderna del átomo como un componente de los elementos químicos, cuando señaló que los elementos están formados por partículas indivisibles llamados átomos.
Además, postuló que los compuestos se forman cuando átomos de diferentes elementos se combinan entre sí en proporciones de número enteros sencillos.
Dalton completó los trabajos investigativos de Proust. Señaló la existencia de dos óxidos del estaño, con porcentajes de 88,1% y 78,7% de estaño con los correspondientes porcentajes de oxígeno, 11,9% y 21,3%, respectivamente.
Agua y peróxido de hidrógeno
Demuestre que los compuestos agua, H2O, y peróxido de hidrógeno, H2O2, cumplen la Ley de las Proporciones Múltiples.
Pesos atómicos de los elementos: H = 1 g/mol y oxígeno = 16 g/mol.
Pesos moleculares de los compuestos: H2O = 18 g/mol y H2O2 = 34 g/mol.
El hidrógeno es el elemento con una cantidad fija en H2O y H2O2, por lo que se establecerán las proporciones entre O y H en ambos compuestos.
Proporción O/H en H2O = (16 g/mol) / (2 g/mol)
= 8/1
Proporción O/H en H2O2 = (32 g/mol) / (2 g/mol)
= 16/1
Relación entre ambas proporciones = (16/1) / (8/1)
= 2
Entonces, la relación de la proporción O/H entre el peróxido de hidrógeno y el agua es de 2, un número entero y sencillo. Por lo queda demostrado el cumplimiento de la Ley de las Proporciones Múltiples.
Óxidos de nitrógeno
¿Qué masa de Oxígeno se combina con 3,0 g de nitrógeno en a) óxido nítrico, NO y b) dióxido de nitrógeno, NO2. Demuestre que el NO y el NO2 cumplen la Ley de las Proporciones Múltiples.
Masa de nitrógeno = 3 g
Pesos atómicos: nitrógeno, 14 g/mol, y oxígeno, 16 g/mol.
Cálculos
En el NO, un átomo de N se combina con 1 atomo de O, por lo que puede calcularse la masa de oxígeno que se combina con 3 g de nitrógeno mediante el planteamiento siguiente:
g de O = g nitrógeno · (PA. O / PA. N)
= 3 g · (16 g/mol / 14 g/mol)
= 3,43 g O
En el NO2, un átomo de N se combina con 2 átomos de O, por lo que la masa de oxígeno que se combina es:
g de oxígeno = 3 g · (32 g/mol / 14 g/mol)
= 6,86 g O
Proporción O/N en NO = 3,43 g O/ 3 g N
= 1,143
Proporción O/N en NO2 = 6,86 g O / 3 g N
= 2,282
Valor de la relación entre las proporciones O/N = 2,282 / 1,143
= 2
Entonces, el valor de la relación entre las proporciones O/N es de 2, un número entero y sencillo. Por lo tanto, se cumple la Ley de las Proporciones Múltiples.
Esta ley formulada por Richter y Carl F. Wenzel por separado, establece que las proporciones másicas de dos compuestos con un elemento en común, permite determinar la proporción de un tercer compuesto entre los otros elementos si reaccionaran.
Por ejemplo, si se tienen los dos compuestos AB y CB, se observa que el elemento común es el B.
La ley de Richter-Wenzel o de las proporciones recíprocas dice que, conociendo cuánto de A reacciona con B para dar AB, y cuánto de C reacciona con B para dar CB, se puede calcular la masa de A que se necesita para reaccionar con una masa de C para formar AC.
Y el resultado, es que la proporción A:C o A/C debe ser un múltiplo o submúltiplo de A/B o C/B. Sin embargo, no siempre se cumple esta ley, en especial cuando los elementos presentan varios estados de oxidación.
De todas las leyes ponderales esta es quizás la más “abstracta” o complicada. Pero si se analiza desde un punto de vista matemático, se verá que consiste únicamente de factores de conversión y cancelaciones.
Metano
Si se sabe que 12 g de carbono reacciona con 32 g de oxígeno para formar dióxido de carbono; y que, por otro lado, 2 g de hidrógeno reacciona con 16 g de oxígeno para formar agua, entonces se puede estimar las proporciones másicas C/O y H/O para el CO2 y H2O, respectivamente.
Calculando C/O y H/O se tiene:
C/O = 12g C / 32g O
= 3/8
H/O = 2g H / 16g O
=1/8
El oxígeno es el elemento en común, y se desea conocer cuánto de carbono reacciona con hidrógeno para producir metano; es decir, se quiere calcular C/H (o H/C). Entonces, es necesario hacer una división de las proporciones anteriores para demostrar si se cumple o no la reciprocidad:
C/H = (C/O) / (H/O)
Nótese que de esta manera se cancela los O y queda C/H:
C/H = (3/8) / (1/8)
= 3
Y 3 es un múltiplo de 3/8 (3/8 x 8). Esto significa que 3 g de C reacciona con 1 g de H para dar metano. Pero, para poder compararlo con el CO2, se multiplica C/H por 4, que es igual a 12; esto da 12 g de C que reacciona con 4 g de H para formar metano, lo cual también es cierto.
Sulfuro de magnesio
Si se sabe que 24 g de magnesio reacciona con 2 g de hidrógeno para formar hidruro de magnesio; y que además, 32 g de azufre reacciona con 2 g de hidrógeno para formar sulfuro de hidrógeno, el elemento en común es el hidrógeno y se quiere calcular Mg/S a partir de Mg/H y H/S.
Calculando entonces Mg/H y H/S por separado se tiene:
Mg/H = 24g Mg / 2g H
= 12
H/S = 2g H / 32g S
= 1/16
Sin embargo, conviene utilizar S/H para cancelar el H. Por lo tanto, S/H es igual a 16. Hecho esto, se procede a calcular Mg/S:
Mg/S = (Mg/H) / (S/H)
= (12 / 16)
= 3/4
Y 3/4 es un submúltiplo de 12 (3/4 x 16). La proporción Mg/S señala que 3 g de Mg reacciona con 4 g de azufre para formar sulfuro de magnesio. Sin embargo, hay que multiplicar Mg/S por 8 para poder compararlo con Mg/H. Así, 24 g de Mg reacciona con 32 g de azufre para dar este sulfuro metálico.
Cloruro de aluminio
Se sabe que 35,5 g de Cl reacciona con 1 g de H para formar HCl. Asimismo, 27 g de Al reacciona con 3 g de H para formar AlH3. Calcule la proporción del cloruro de aluminio y diga si tal compuesto obedece la ley de Richter-Wenzel.
Nuevamente, se procede a calcular Cl/H y Al/H por separado:
Cl/H = 35,5g Cl / 1g H
= 35,5
Al/H = 27g Al/ 3g H
= 9
Ahora, se calcula Al/Cl:
Al/Cl = (Al/H) / (Cl/H)
= 9 / 35,5
≈ 0,250 o 1/4 (en realidad es 0,253)
Es decir, que 0,250 g de Al reacciona con 1 g de Cl para formar la correspondiente sal. Pero, otra vez, se debe multiplicar Al/Cl por un número que permita compararlo (para mayor comodidad) con Al/H.
Imprecisiones en el cálculo
Se multiplica entonces Al/Cl por 108 (27/0,250), dando 27 g de Al que reacciona con 108 g de Cl. Esto no ocurre precisamente así. Si tomamos por ejemplo el valor 0,253 por Al/Cl, y lo multiplicamos por 106,7 (27/0,253), se tendrá que 27 g de Al reacciona con 106,7 g de Cl; lo cual, se aproxima más a la realidad (AlCl3, con un PA de 35,5 g/mol para el Cl).
Aquí se observa cómo la ley de Richter puede empezar a tambalear por cuestiones de precisión y mal uso de los decimales.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Flores, J. Química (2002). Editorial Santillana.
- Joaquín San Frutos Fernández. (s.f.). Las leyes ponderales y volumétricas. Recuperado de: encina.pntic.mec.es
- Toppr. (s.f.). Laws of Chemical Combination. Recuperado de: toppr.com
- Brilliant. (2019). Laws of Chemical Combination. Recuperado de: brilliant.org
- Chemistry LibreTexts. (15 de julio de 2015). Fundamental Chemical Laws. Recuperado de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (18 de enero de 2019). Law of Conservation of Mass. Recuperado de: thoughtco.com
