Selenio: historia, propiedades, estructura, obtención, usos
El selenio es un elemento químico no metálico que pertenece al grupo 16 de la tabla periódica y que viene representado por el símbolo Se. Este elemento tiene propiedades intermedias entre el azufre y el telurio, los cuales son miembros de su mismo grupo.
El selenio fue descubierto en el año 1817 por Jöhs J. Berzelius y John G. Gahn, quienes al vaporizar la pirita observaron un residuo de color rojo (imagen inferior). Al principio lo confundieron con el telurio, pero luego se dieron cuenta de que estaban frente a un elemento nuevo.

Berzelius denominó al nuevo elemento como selenium, basado en el nombre de “selene” que significa “diosa de la luna”. El selenio es un oligoelemento esencial para las plantas y los animales, aunque en altas concentraciones es un elemento tóxico.
El selenio tiene tres formas alotrópicas principales: el rojo, negro y gris. Este último tiene la propiedad de modificar su conductancia eléctrica en función de la intensidad de la luz que lo irradia (fotoconductor), por lo cual ha tenido muchas aplicaciones.
El selenio está ampliamente distribuido en la corteza terrestre, sin embargo los minerales que lo contienen no son abundantes, por lo que no existe una explotación minera del selenio.
Se obtiene principalmente como un producto secundario del proceso de la refinación por electrólisis del cobre. El selenio se acumula en el limo que se encuentra en el ánodo de las celdas de electrólisis.
Los seres humanos poseen alrededor de 25 selenoproteínas, algunas de las cuales cumplen una acción antioxidante y controlan la generación de radicales libres. Asimismo, existen aminoácidos de selenio, tales como la selenometionina y la selenocisteína.
Índice del artículo
- 1 Historia
- 2 Propiedades físicas y químicas
- 2.1 Apariencia
- 2.2 Peso atómico estándar
- 2.3 Número atómico (Z)
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Densidad
- 2.7 Calor de fusión
- 2.8 Calor de vaporización
- 2.9 Capacidad calórica molar
- 2.10 Números de oxidación
- 2.11 Electronegatividad
- 2.12 Energía de ionización
- 2.13 Orden Magnética
- 2.14 Dureza
- 2.15 Isótopos
- 2.16 Alotropía
- 3 Reactividad
- 4 Estructura y configuración electrónica
- 5 Dónde se encuentra y producción
- 6 Papel biológico
- 7 Riesgos
- 8 Usos
- 9 Referencias
El alquimista Arnold de Villanova es posible que haya observado el selenio en 1230. Este se formó en medicina en La Sorbona de Paris, e inclusive fue el médico del Papa Clemente V.
Villanova en su libro Rosarium Philosophorum describe a un azufre rojo o “rebeum de azufre” que había quedado en un horno después de vaporizar el azufre. Este azufre rojo pudo haber sido un alótropo del selenio.
En 1817, Jöhs Jakob Berzelius y John Gottlieb Gahn descubrieron el selenio en una planta química para la producción de ácido sulfúrico, cerca de Gripsholm, Suecia. La materia prima para la elaboración del ácido era pirita, la cual extraían de una mina de Falun.
A Berzelius le llamó la atención la existencia de un residuo rojo que quedaba en el recipiente de plomo después de haberse quemado el azufre.
Asimismo, Berzelius y Gahn observaron que el residuo rojo tenía un olor fuerte a rábano picante, semejante al que presenta el telurio. Razón por la cual, le escribió a su amigo Marect que creían que el depósito observado era un compuesto de telurio.
Sin embargo, Berselius continuó analizando el material depositado al incinerar la pirita y recapacitó que en la mina de Falun no se había hallado telurio. Concluyó en febrero de 1818 que había descubierto un nuevo elemento.
Berzelius señaló que el nuevo elemento era una combinación del azufre y el telurio, y que la similitud del telurio con el nuevo elemento le había dado la oportunidad de nombrar a la nueva sustancia selenium.
Berzelius explicó que “tellus” significa diosa de la tierra. Martin Klaport en 1799 le colocó este nombre al telurio y escribió: “Ningún elemento por sí solo se llama así. ¡Tenía que hacerse!”.
Por la similitud del telurio con la nueva sustancia, Berzelius la denominó con la palabra selenium, derivada de la palabra griega “selene” que significa “diosa de la luna”.
En 1873 Willoughby Smith descubrió que la conductividad eléctrica que presentaba el selenio dependía de la luz que lo irradiaba. Esta propiedad permitió que el selenio tuviese numerosas aplicaciones.
Alexander Graham Bell en 1979 utilizó el selenio en su fotófono. El selenio produce una corriente eléctrica proporcional a la intensidad de la luz que lo ilumina, utilizándose en medidores de luz, mecanismos de seguridad para la apertura y cierre de puertas, etc.
Se inició el uso de los rectificadores de selenio en electrónica a partir de la década de 1930, con numerosas aplicaciones comerciales. En la década de 1970 fue suplantado en los rectificadores por el silicio.
En 1957 se descubrió que el selenio era un elemento esencial para la vida de los mamíferos, ya que estaba presente en enzimas que protegen del oxígeno reactivo y los radicales libres. Además, se descubrió la existencia de aminoácidos como la selenometionina.
Al haber varios alótropos para el selenio, su apariencia física varía. Por lo común se presenta como un sólido rojizo en forma de polvo.
78,971 u
34
221 ºC
685 ºC
La densidad del selenio varía en función de cuál alótropo o polimorfo se considere. Algunas de sus densidades determinadas a temperatura ambiente son:
Gris: 4,819 g/cm3
Alfa: 4,39 g/cm3
Vítreo: 4,28 g/cm3
Estado líquido (punto de fusión): 3,99 g/cm3
Gris: 6,69 kJ/mol
95,48 kJ/mol
25,363 J/(mol·K)
El selenio puede enlazarse en sus compuestos manifestando los siguientes números o estados de oxidación:-2, -1, +1, +2, +3, +4, +5, +6. Entre todos ellos, los más importantes son el -2 (Se2-), +4 (Se4+) y +6 (Se6+).
Por ejemplo, en el SeO2 el selenio tiene número de oxidación de +4; es decir, se asume la existencia del catión Se4+ (Se4+O22-). Similarmente con el SeO3 el selenio tiene número de oxidación de +6 (Se6+O32-).
En el seleniuro de hidrógeno, H2Se, el selenio tiene número de oxidación de -2; es decir, nuevamente, se asume la existencia del ion o anión Se2- (H2+Se2-). Esto es así porque el selenio es más electronegativo que el hidrógeno.
2,55 en la escala de Pauling.
-Primera: 941 kJ/mol.
-Segunda: 2.045 kJ/mol.
-Tercera: 2.973,7 kJ/mol.
Diamagnética.
2,0 en la escala de Mohs.
Son cinco los isótopos naturales y estables del selenio, los cuales se muestran a continuación con sus respectivas abundancias:
–74Se (0,86%)
–76Se (9,23%)
–77Se (7,6%)
–78Se (23,69%)
–80Se (49,8%)

El selenio preparado en reacciones químicas es un polvo amorfo de color rojo ladrillo, que cuando se funde rápidamente origina la forma negra vítrea, semejante a cuentas de rosario (imagen superior). El selenio negro es un sólido quebradizo y lustroso.
Además, el selenio negro es ligeramente soluble en sulfuro de carbono. Cuando se calienta esta disolución a 180 ºC precipita el selenio gris, su alótropo más estable y denso.
El selenio gris es resistente a la oxidación y es inerte a la acción de los ácidos no oxidantes. La propiedad principal de este selenio es su fotoconductividad. Al ser iluminado aumenta su conductividad eléctrica en un factor de 10 a 15 veces.
El selenio en sus compuestos existe en los estados de oxidación -2, +4 y +6. Manifiesta una clara tendencia a formar ácidos en los estados de oxidación superiores. Los compuestos que tengan el selenio con el estado de oxidación -2, se denominan seleniuros (Se2-).
El selenio reacciona con hidrógeno para formar el seleniuro de hidrógeno (H2Se), un gas incoloro, inflamable y maloliente.
El selenio arde emitiendo una llama azul y formando el dióxido de selenio:
Se8 (s) + 8 O2 => 8 SeO2 (s)
El óxido de selenio es una sustancia polimérica, blanca y sólida. Su hidratación produce el ácido selenioso (H2SeO3). También el selenio forma el trióxido de selenio (SeO3), análogo al del azufre (SO3).
El selenio reacciona con el flúor para formar el hexafluoruro de selenio:
Se8 (s) + 24 F2 (g) => 8 SeF6 (l)
El selenio reacciona con cloro y bromo para formar dicloruro y dibromuro de disilenio, respectivamente:
Se8 (s) + 4 Cl2 => 4 Se2Cl2
Se8 (s) + 4 Br2 => 4 Se2Br2
El selenio también puede formar SeF4 y SeCl4.
Por otro lado, el selenio forma compuestos en los que un átomo de selenio se une con uno de halógeno y otro de oxígeno. Un ejemplo importante es el oxicloruro de selenio (SeO2Cl2), con el selenio en estado de oxidación +6, un solvente extremadamente poderoso.
El selenio reacciona con los metales para formar seleniuros de aluminio, cadmio y sodio. La ecuación química de abajo corresponde a la de formación del seleniuro de aluminio:
3 Se8 + 16 Al => 8 Al2Se3
El selenio forma sales conocidas como selenitas; por ejemplo: selenita de plata (Ag2SeO3) y selenita de sodio (Na2SeO3). Este nombre ha sido utilizado, en un contexto literario, para referirse a habitantes de la Luna: los selenitas.
El ácido más importante del selenio es el ácido selénico (H2SeO4). Es tan fuerte como el ácido sulfúrico y se reduce más fácilmente.
El selenio tiene seis electrones de valencia, razón por la cual se ubica en el grupo 16, el mismo que del oxígeno y azufre. Estos seis electrones se encuentran en los orbitales 4s y 4p, de acuerdo a su configuración electrónica:
[Ar] 3d10 4s2 4p4
Necesita por lo tanto, al igual que el azufre, formar dos enlaces covalentes para completar su octeto de valencia; aunque tiene disponibilidad de sus orbitales 4d para enlazarse con más de dos átomos. Así pues, tres átomos de selenio se aproximan y forman dos enlaces covalentes: Se-Se-Se.
El selenio con su mayor masa atómica tiene una tendencia natural a formar estructuras regidas por enlaces covalentes; en lugar de disponerse como moléculas diatómicas Se2, Se=Se, análogas al O2, O=O.
Entre las estructuras moleculares que adoptan los átomos de selenio pueden mencionarse dos en términos generales: anillos o cadenas. Nótese que en el caso hipotético del Se3, los átomos Se de los extremos todavía requieren de electrones; por lo tanto, deben enlazarse a otros átomos, de manera sucesiva, hasta que se la cadena pueda cerrarse en un anillo.
Los anillos más comunes son los de ocho miembros o átomos de selenio: Se8 (una corona selenita). ¿Por qué ocho? Porque mientras más pequeño es el anillo, mayor tensión sufrirá; esto es, los ángulos de sus enlaces se desvían de los valores naturales fijados por sus hibridaciones sp3 (similar como ocurre con los cicloalcanos).
Al haber ocho átomos, la separación entre los átomos Se-Se es la suficiente para que sus enlaces estén “relajados” y no “doblados”; aunque el ángulo de sus enlaces sea de 105,7 º y no 109,5 º. Por otro lado, puede haber anillos más pequeños: Se6 y Se7.
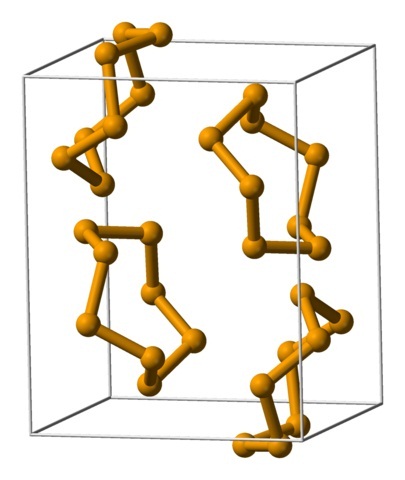
En la imagen superior se muestran las unidades anillares Se8. Nótese el parecido que tienen con las coronas de azufre; solo que son más grandes y pesadas.
Además de los anillos, los átomos de selenio también pueden disponerse en cadenas helicoidales (pensar en las escaleras de caracol):
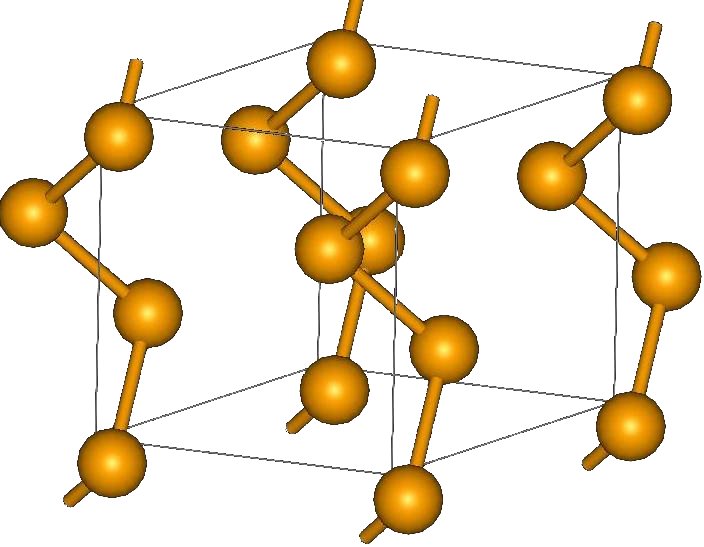
En sus extremos puede que haya dobles enlaces terminales (-Se=Se), o anillos Se8.
Teniendo en cuenta que puede haber anillos o cadenas helicoidales de selenio, y que además las dimensiones de los mismos pueden variar dependiendo del número de átomos que contengan, entonces es evidente que haya más de un alótropo para este elemento; esto es, sólidos de selenio puros pero con distintas estructuras moleculares.
Selenio rojo
Entre los alótropos más destacados del selenio tenemos al rojo, el cual puede presentarse como un polvo amorfo, o como cristales monoclínicos y polimórficos (ver imagen de los anillos Se8).
En el selenio rojo amorfo las estructuras se hallan desordenadas, sin patrones aparentes; mientras que en el cristalino, los anillos establecen una estructura monoclínica. El selenio rojo cristalino es polimórfico, teniendo tres fases: α, β y γ, las cuales se diferencian en sus densidades.
Selenio negro
La estructura del selenio negro también consiste de anillos; pero no de ocho miembros, sino de muchos más, llegando a haber hasta anillos de mil átomos (Se1000). Se dice entonces que su estructura es compleja y consta de anillos poliméricos; algunos más grandes o pequeños que otros.
Al haber anillos poliméricos de diferentes tamaños, es difícil esperar que establezcan un orden estructural; por lo que el selenio negro también es amorfo, pero en contraste con el polvo rojizo mencionado arriba, este posee contexturas vidriosas, aunque es quebradizo.
Selenio gris
Y finalmente, de los alótropos más simples del selenio está el gris, el cual sobresale por encima de los demás al ser el más estable bajo condiciones normales, y por tener además un aspecto metálico.
Sus cristales pueden ser hexagonales o trigonales, establecidos por las fuerzas de dispersión de London entre sus cadenas helicoidales poliméricas (imagen superior). El ángulo de sus enlaces es de 130,1 º, lo cual indica una desviación positiva de los entornos tetraédricos (con ángulos de 109,5 º).
Es por eso que las cadenas helicoidales de selenio dan la impresión de estar “abiertas”. A modo de elucubración, en esta estructura los átomos Se están enfrentados, por lo que en teoría debe a haber un mayor traslape de sus orbitales para crear bandas de conducción.
El calor con el incremento de las vibraciones moleculares perjudica dichas bandas al desordenarse las cadenas; mientras que la energía de un fotón incide directamente sobre los electrones, excitándolos y promoviendo sus transacciones. Desde esta visión resulta “fácil” imaginarse la fotoconductividad para el selenio gris.
Aunque se encuentra ampliamente distribuido, el selenio es un elemento raro. Se encuentra en estado nativo asociado al azufre y minerales como eucairita (CuAgSe), claustalita (PbSe), naumanita (Ag2Se), y crookesita [(CuTiAg)2Se].
El selenio se encuentra como una impureza que reemplaza al azufre en una pequeña porción de los minerales sulfurosos de metales; tales como cobre, plomo, plata, etc.
Hay suelos en los que existe selenio bajo la forma soluble de selenatos. Estos son llevados por las aguas de las lluvias hacia los ríos y de allí, hacia el océano.
Algunas plantas son capaces de absorber y concentrar el selenio. Por ejemplo una taza de nueces de Brasil contiene 544 µg de selenio, una cantidad que equivale a un 777% de la cantidad de selenio recomendada diariamente.
En los seres vivos el selenio se encuentra en algunos aminoácidos, tales como: selenometionina, selenocisteína y metilselenocisteína. La selenocisteína y el selenito son reducidos a seleniuro de hidrógeno.
No existe explotación minera del selenio. La mayor parte es obtenida como un producto secundario del proceso de refinación por electrólisis del cobre, hallándose en el limo que se acumula en el ánodo.
El primer paso consiste en la producción de dióxido de selenio. Para ello se trata el limo anódico con carbonato de sodio para producir su oxidación. Luego al óxido de selenio se le añade agua y se acidifica para formar el ácido selenioso.
Por último, se trata el ácido selenioso con dióxido de azufre para producir su reducción y obtener el selenio elemental.
En otro método en la mezcla del limo y lodo formada en la producción de ácido sulfúrico, se obtiene un selenio rojo impuro que se disuelve en ácido sulfúrico.
Se forman entonces el ácido selenioso y el ácido selénico. Este ácido selenioso recibe el mismo tratamiento que el método anterior.
También se puede usar cloro, el cual actúa sobre los seleniuros metálicos para producir compuestos clorados de selenio volátiles; tales como: Se2Cl2, SeCl4, SeCl2 y SeOCl2.
Estos compuestos, en un proceso realizado en el agua, se convierten en ácido selenioso, el cual es tratado con dióxido de azufre para liberar el selenio.
El selenio es un oligoelemento esencial para las plantas y los animales, cuya deficiencia en los seres humanos ha causado trastornos graves como la enfermedad de Keshan; una enfermedad caracterizada por un daño al miocardio.
Además, la deficiencia de selenio está asociada a la infertilidad masculina y puede jugar un papel en la enfermedad de Kashin-Beck, un tipo de osteoartritis. Asimismo, se ha observado una deficiencia de selenio en la artritis reumatoidea.
El selenio es un componente de enzimas con acción antioxidante, tales como la glutationa peroxidasa y la tiorredoxina reductasa que actúan en la eliminación de sustancias con oxígeno reactivo.
Además, el selenio es un cofactor de las desiodinasas de las hormonas tiroideas. Estas enzimas son importantes en la regulación del funcionamiento de las hormonas tiroideas.
Se ha señalado el uso del selenio en el tratamiento de la enfermedad de Hasimoto, una enfermedad autoinmune con la formación de anticuerpos contra las células de la tiroides.
También se ha utilizado el selenio para reducir los efectos tóxicos del mercurio, ya que algunas de sus acciones se ejercen sobre las enzimas antioxidantes dependientes del selenio.
El hombre posee cerca de 25 selenoproteínas que ejercen una acción antioxidante para la protección contra el estrés oxidativo, iniciado por un exceso de especies reactivas de oxigeno (ROS) y especies reactivas de nitrógeno (NOS).
Se ha detectado la presencia de los aminoácidos selenometiocina y selenocisteína en los seres humanos. La selenometionina se usa como suplemento dietético en el tratamiento de los estados de deficiencia de selenio.
Una concentración corporal elevada de selenio puede tener sobre la salud numerosos efectos dañinos, comenzando por cabellos quebradizos y uñas quebradizas, hasta erupciones cutáneas, calor, edema de la piel y dolores severos.
Al tratar el selenio en contacto con los ojos, las personas pueden manifestar ardor, irritación y lagrimeo. Mientras, una exposición prolongada a un humo con alto contenido de selenio, puede producir edema pulmonar, aliento de ajo y bronquitis.
Además, la persona puede experimentar neumonitis, náuseas, escalofríos, fiebre, dolor de garganta, diarrea y hepatomegalia.
El selenio puede interaccionar con otras medicinas y suplementos dietéticos, tales como antiácidos, drogas antineoplásicas, corticosteroides, niacina y píldoras para el control de la natalidad.
El selenio ha sido asociado a un mayor riesgo de contraer un cáncer de piel. En un estudio del National Cancer Institute se señaló que los hombres con alta concentración corporal de selenio tenían el doble de probabilidad de sufrir de un cáncer de próstata agresivo.
Un estudio señala que la ingesta diaria de 200 µg de selenio, aumenta en un 50% la posibilidad de desarrollar una diabetes tipo II.
El sulfuro de selenio es utilizado en el tratamiento de la seborrea, así como del cabello grasoso o con caspa.
Se usa como medicina alternativa en el tratamiento de la enfermedad de Hasimoto, una enfermedad autoinmune de la tiroides.
El selenio reduce la toxicidad del mercurio, cuya una de sus actividades tóxicas es ejercida sobre las enzimas desoxidantes, que usan como cofactor el selenio.
La utilización del óxido de selenio en la electrólisis de manganeso reduce en forma considerable los costos de la técnica, ya que disminuye el consumo eléctrico.
El selenio es utilizado como pigmento en pinturas, plásticos, cerámicas y vidrios. Dependiendo del selenio usado el color del vidrio varía de un rojo profundo a un naranja ligero.
Debida a la propiedad del selenio gris de cambiar su conductividad eléctrica en función de la intensidad de la luz que lo irradia, el selenio ha sido utilizado en fotocopiadoras, fotocélulas, fotómetros y células solares.
La utilización del selenio en las fotocopiadoras fue una de las principales aplicaciones del selenio; pero la aparición de fotoconductores orgánicos ha ido disminuyendo su uso.
El selenio se emplea para la decoloración de los vidrios, a consecuencia de la presencia del hierro que produce una coloración verde o amarilla. Además, permite una coloración roja del vidrio, dependiendo del uso que quiera darse de él.
El selenio dietilditiocarbonato es usado como un agente vulcanizante de los productos de caucho.
El selenio se usa en combinación con el bismuto en el latón, con el fin de sustituir al plomo; elemento muy tóxico que se ha disminuyendo su uso debido a las recomendaciones de los organismos de salud.
El selenio es agregado a bajas concentraciones al acero y a las aleaciones de cobre para mejorar la facilidad de utilización de estos metales.
Los rectificadores de selenio comenzaron a utilizarse en 1933 hasta la década de 1970, cuando fueron reemplazados por el silicio por su bajo costo y calidad superior.
- Royal Australian Chemical Institute. (2011). Selenium. [PDF]. Recuperado de: raci.org.au
- Wikipedia. (2019). Selenium. Recuperado de: en.wikipedia.org
- Sato Kentaro. (s.f.). New Allotropes of Main Group Elements. [PDF]. Recuperado de: tcichemicals.com
- Dr. Dough Stewart. (2019). Selenium Element Facts. Chemicool. Recuperado de: chemicool.com
- Robert C. Brasted. (28 de agosto de 2019). Selenium. Encyclopædia Britannica. Recuperado de: britannica.com
- Marques Miguel. (s.f.). Selenium. Recuperado de: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, Ph.D. (03 de Julio de 2019). Selenium Facts. Recuperado de: thoughtco.com
- Lenntech B. V. (2019). Periodic table: selenium. Recuperado de: lenntech.com
- Tinggi U. (2008). Selenium: its role as antioxidant in human health. Environmental health and preventive medicine, 13(2), 102–108. doi:10.1007/s12199-007-0019-4
- Office of Dietary Supplements. (09 de julio de 2019). Selenium: Facts Sheet for Health Professionals. National Institute of Health. Recuperado de: ods.od.nih.gov
