Ciclobutano: estructura, propiedades, usos y síntesis
El ciclobutano es un hidrocarburo que consiste de un cicloalcano de cuatro carbonos, cuya fórmula molecular es C4H8. También se le puede llamar tetrametileno, considerando que son cuatro unidades CH2 que conforman un anillo con geometría cuadrada, aunque el nombre ciclobutano es más aceptado y conocido.
A temperatura ambiente es un gas incoloro, inflamable y que arde con una llama brillante. Su uso más primitivo es como fuente de calor al quemarlo; sin embargo, su base estructural (el cuadrado) abarca aspectos biológicos y químicos profundos, y colabora de cierta manera con las propiedades de dichos compuestos.
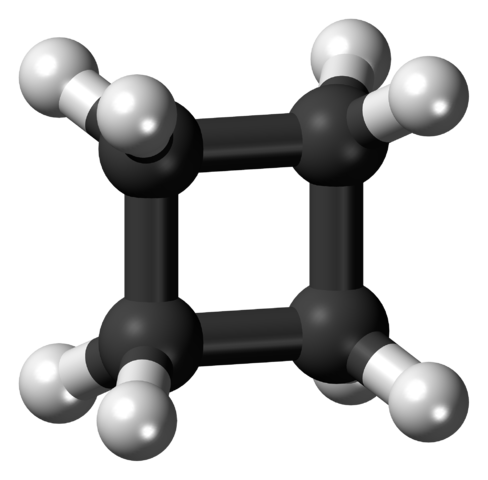
En la imagen superior se muestra una molécula de ciclobutano con estructura cuadrada. En el siguiente apartado se explicará por qué esta conformación es inestable, ya que sus enlaces se encuentran tensos.
Después del ciclopropano, es el cicloalcano más inestable, ya que mientras más pequeño sea el tamaño del anillo, más reactivo será. De acuerdo a esto, el ciclobutano es más inestable que los ciclos pentano y hexano. No obstante, es curioso presenciar en sus derivados un núcleo o corazón cuadrado, el cual, como se verá, es dinámico.
Índice del artículo
En la primera imagen se abordó la estructura del ciclobutano como un simple cuadrado carbonado e hidrogenado. Sin embargo, en este cuadrado perfecto los orbitales sufren una severa torcedura de sus ángulos originales: están separados por un ángulo de 90º en comparación a los 109,5º para un átomo de carbono con hibridación sp3 (tensión angular).
Los átomos de carbono sp3 son tetraédricos, y para unos tetraedros les resultaría difícil flexionar tanto sus orbitales para crear un ángulo de 90º; pero lo sería aún más para los carbonos con hibridaciones sp2 (120º) y sp (180º) desviar sus ángulos originales. Por esta razón el ciclobutano tiene átomos de carbono sp3 en esencia.
Asimismo, los átomos de hidrógeno se encuentran muy cercanos unos de otros, eclipsados en el espacio. Esto trae como consecuencia un incremento del impedimento estérico, lo cual debilita al supuesto cuadrado por su alta tensión torsional.
Por lo tanto, las tensiones angulares y torsionales (encapsuladas en el término ‘tensión anular’) hacen que esta conformación resulte inestable en condiciones normales.
La molécula de ciclobutano buscará cómo reducir ambas tensiones, y para lograrlo adopta lo que se conoce como conformación mariposa o arrugada (en inglés, puckered).
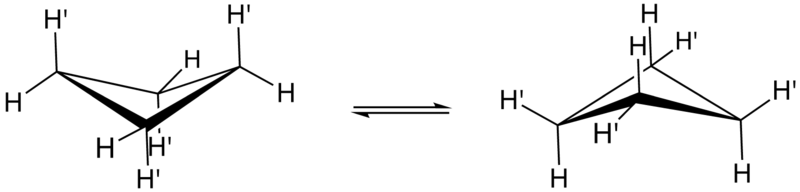
Arriba se muestran las conformaciones verdaderas del ciclobutano. En ellas las tensiones angulares y torsionales disminuyen; ya que, como se puede observar, ahora no todos los átomos de hidrógeno están eclipsados. Sin embargo, hay un costo energético: el ángulo de sus enlaces se agudiza, es decir, baja de 90 a 88º.
Nótese que se puede comparar con una mariposa, cuyas alas triangulares están formadas por tres átomos de carbono; y el cuarto, posicionado en un ángulo de 25º respecto a cada ala. Las flechas con doble sentido señalan que existe un equilibrio entre ambos confórmeros. Es como si la mariposa bajara y subiera sus alas.
En los derivados del ciclobutano, por otro lado, se esperaría que este aletear fuera mucho más lento e impedido espacialmente.
Supóngase que se olvida por unos momentos de los cuadrados, y se reemplazan en su lugar por mariposas carbonadas. Estas en su aletear solo pueden mantenerse unidas en el líquido mediante fuerzas de dispersión de London, las cuales son proporcionales al área de sus alas y a su masa molecular.
Gas incoloro.
56,107 g/mol.
12,6ºC. Por lo tanto, en condiciones frías se podría manipular en principio como cualquier líquido; con el único detalle, de que sería altamente volátil, y todavía sus vapores representarían un riesgo a tener en cuenta.
-91ºC.
50ºC a copa cerrada.
Insoluble en agua, lo que no se extraña dada su naturaleza apolar; pero, es ligeramente soluble en alcoholes, éter y acetona, los cuales son solventes menos polares. Se espera que sea soluble (aunque no esté reportado) lógicamente en solventes apolares como el tetracloruro de carbono, benceno, xileno, etc.
0,7125 a 5ºC (en relación a 1 del agua).
1,93 (en relación a 1 del aire). Esto significa que es más denso que el aire, y por lo tanto, a menos que haya corrientes, su tendencia no será la de ascender.
1.180 mmHg a 25ºC.
1,3625 a 290ºC.
-655,9 kJ/mol.
6,6 Kcal/mol a 25ºC.
El ciclobutano se sintetiza mediante la hidrogenación del ciclobutadieno, cuya estructura es casi la misma, con la única diferencia de que posee un doble enlace; y por lo tanto, es aún más reactivo. Esta es quizás la ruta sintética más simple para obtenerlo, o al menos únicamente a él y no a un derivado.
En el crudo resulta improbable su obtención ya que terminaría reaccionando de tal manera que rompiera el anillo y se formara la cadena línea, es decir, n-butano.
Otro método para obtener el ciclobutano consiste en hacer incidir radiación ultravioleta sobre las moléculas de etileno, CH2=CH2, las cuales se dimerizan. Esta reacción está favorecida fotoquímicamente, pero no termodinámicamente:

La imagen superior resume muy bien lo dicho en el párrafo de arriba. Si en lugar del etileno se tuviera, por ejemplo, dos alquenos cualesquiera, se obtendría un ciclobutano sustituido; o lo que es igual, un derivado del ciclobutano. De hecho, muchos derivados con estructuras interesantes han sido sintetizados mediante este método.
Otros derivados, sin embargo, implican una serie de pasos sintéticos complicados. Por lo tanto, los ciclobutanos (como se les llama a sus derivados), son objeto de estudio para las síntesis orgánicas.
El ciclobutano por sí solo no tiene más uso que servir como fuente de calor; pero, sus derivados, entran en terrenos intrincados en síntesis orgánicas, con aplicaciones en farmacología, biotecnología y medicina. Sin profundizar en estructuras demasiado complejas, las penitrems y el grandisol son ejemplos de ciclobutanos.
Los ciclobutanos tienen por lo general propiedades que resultan benéficas para los metabolismos de las bacterias, plantas, invertebrados marinos y hongos. Son biológicamente activos, y es por eso que sus usos son muy variados y difíciles de especificar, ya que cada uno tiene su efecto particular en determinados organismos.

El grandisol, por ejemplo, es una feromona del gorgojo (un tipo de escarabajo). Arriba, y para finalizar, se muestra su estructura, considerada un monoterpeno con una base cuadrada de ciclobutano.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons, T.W.; Craig B. Fryhle. (2011). Organic Chemistry. (11th edition). Wiley.
- Wikipedia. (2019). Cyclobutane. Recuperado de: en.wikipedia.org
- PubChem. (2019). Cyclobutane. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Peiris Nicole. (29 de noviembre de 2015). Physical Properties of Cycloalkanes. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Wiberg B. Kenneth. (2005). Cyclobutane—physical properties and theoretical studies. Department of Chemistry, Yale University.
- Klement Foo. (s.f.). Cyclobutanes in Organic Synthesis. Recuperado de: scripps.edu
- Myers. (s.f.). Cyclobutanes Synthesis. Chem 115. Recuperado de: hwpi.harvard.edu
