Bórax: historia, estructura, propiedades, usos, síntesis, riesgos
El bórax o borato de sodio es una denominación para un grupo de compuestos químicos con una fórmula base de Na2B4O7. Se trata de una sal higroscópica capaz de formar numerosos hidratos, además de enriquecerse estructuralmente por la presencia de ciertas impurezas metálicas.
Los principales compuestos que reciben el nombre de bórax son los siguientes: tetraborato sódico anhidro, Na2B4O7; tetraborato sódico pentahidratado (Na2B4O7).5H2O; y tetraborato sódico decahidratado, Na2B4O7.10H2O, o su equivalente, el tetraborato sódico octahidratado, Na2B4O5(OH)4.8H2O.

Tal como puede apreciarse, todos los sólidos anteriores difieren únicamente en su grado de hidratación; unos tienen más moléculas de agua en sus cristales que otros. Físicamente el bórax es parecido a pedazos o cristales robustos de tiza (imagen superior).
En forma natural el bórax es encontrado en sedimentos de lagos estacionales, desecados por la evaporación. Se produce bórax en Turquía, Searles Lakes (California), en el desierto de Atacama, Chile, Bolivia, el Tibet y Rumanía. Sintéticamente pueden obtenerse cristales de bórax mediante un proceso lento de nucleación; es decir, uno en el que se favorece el crecimiento de los cristales.
El tetraborato sódico, anhidro y decahidratado, son poco solubles en agua fría; pero aumenta su solubilidad con un incremento de la temperatura. El Na2B4O7.10H2O es muy soluble en etilenglicol, moderadamente soluble en etanol y poco soluble en acetona; estos son solventes menos polares que el agua.
El bórax tiene numerosas aplicaciones, tales como en la elaboración de detergentes y jabones; como retardante del fuego del material celulósico; en la producción de la fibra de vidrio; en la limpieza de superficies duras como metales, vidrios y cerámicas; y en la inhibición de la corrosión, entre otros usos.
El bórax es irritante para los ojos, la piel y en el tracto respiratorio. Por ingestión puede producir, entre otros síntomas, vómitos, diarrea, flacidez, decaimiento y convulsiones. Actualmente se sospecha que puede tener efectos dañinos sobre la reproducción humana.
Índice del artículo
- 1 Historia
- 2 Estructura del bórax
- 3 Cristales
- 4 Propiedades
- 5 Usos
- 5.1 Acción antioxidante
- 5.2 Elaboración de adhesivos
- 5.3 Retardante del fuego
- 5.4 Elaboración de vidrio borosilicado (Pyrex)
- 5.5 Emulsionante
- 5.6 Material de limpieza
- 5.7 Usos médicos
- 5.8 Amortiguador de pH
- 5.9 Disminución de la dureza del agua
- 5.10 Fertilizante y abono
- 5.11 Conservación de la madera
- 5.12 Fundente y flujo
- 5.13 Otros
- 6 Síntesis
- 7 Riesgos
- 8 Referencias
La historia del bórax es confusa. Se señala que fue descubierto en el lecho de un lago del Tibet, desecado por la evaporación. Era trasladado en el siglo VIII del Tibet a la Arabia Saudita, siguiendo la llamada Ruta de la Seda.
El término “bórax” se popularizó a raíz de las numerosas aplicaciones que le fueron encontradas y comercializadas bajo el nombre de 20 Mule Team Borax Tradermax, el cual hacía referencia a la forma en que era transportado el bórax a través de los desiertos de Nevada y California.
Otra versión de su descubrimiento señala que los egipcios conocían desde hace mucho de su existencia, usándolo en la soldaduras de metales mediante el calor. Además, lo empleaban en medicina y en el proceso de momificación. El bórax fue trasladado a Europa en el siglo XIII por Marco Polo.
A mediados del siglo XIX se descubrieron grandes yacimientos de bórax en el desierto de Mogave, lo que hizo común su uso desde entonces.
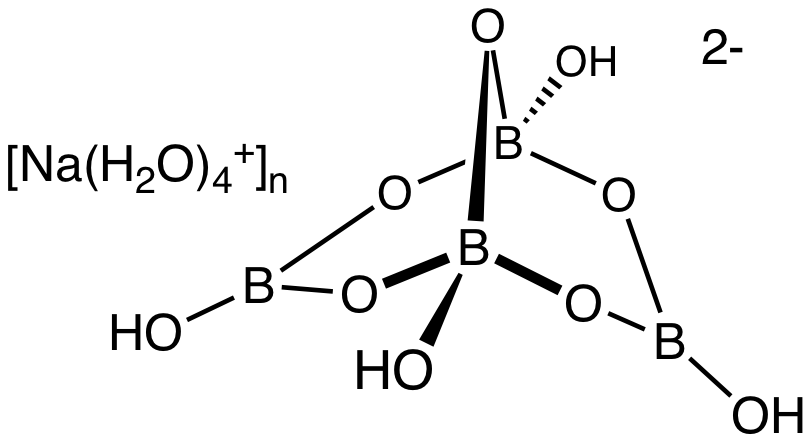
En la imagen superior se muestran los iones que conforman el bórax, específicamente correspondientes a un sólido con una fórmula composicional de Na2[B4O5(OH)4]·8H2O (o Na2B4O7·10H2O).
Primeramente, puede notarse la estructura enjaulada del anión [B4O5(OH)4]2- (aunque debiera tener dos grupos -OH desprotonados, -O–), en la cual se aprecia un anillo octagonal (cuatro átomos de B y cuatro de O), con un puente B-O-B dividiéndolo en dos mitades.
Dicha jaula no permanece estática, sino que vibra y adopta distintas conformaciones en el espacio; empero, en menor grado en las cercanías del puente. Asimismo, puede notarse que está muy “oxigenada”; es decir, cuenta con muchos átomos de oxígeno, capaces de interactuar con moléculas de agua mediante puentes de hidrógeno.
No es de extrañarse entonces que los cristales de bórax puedan hidratarse y generar numerosos hidratos. Así, para el sólido Na2[B4O5(OH)4]·8H2O, hay ocho moléculas de H2O interaccionando con la jaula de borato, y al mismo tiempo, con los centros metálicos de Na+.
Por el lado del catión, se tiene el complejo acuoso [Na(H2O)4]+n, donde el valor de n dependerá de la proporción anión/catión. En el sólido superior, n = 2, por lo que se tiene: [Na2(H2O)8]2+, cuya carga 2+ neutraliza la carga 2- del anión borato.
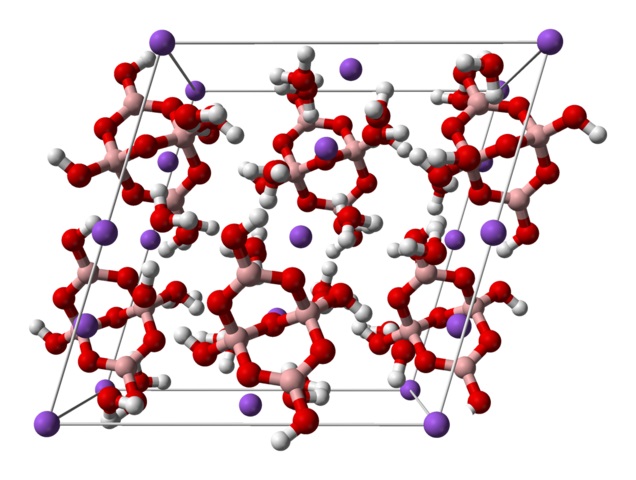
Arriba se tiene la celda unitaria monoclínica para los cristales de Na2[B4O5(OH)4]·8H2O o Na2B4O7·10H2O. Aquí las atracciones electrostáticas y los puentes de hidrógeno rigen o dominan los patrones estructurales originados en cada palmo del cristal.
Los demás hidratos y la sal anhidra pierden una o todas sus moléculas de agua, alterando la composición y estructura del cristal de bórax. En todos ellos, el anión y catión siguen siendo el mismo (a menos que haya impurezas o reacciones laterales), por lo que no pueden generarse confusiones al respecto.
Na2[B4O5(OH)4]·8H2O y Na2B4O7·10H2O son lo mismo. ¿Por qué?
En primer lugar, si se cuentan sus átomos se verán que coinciden en número; y en segundo lugar, en el anión B4O72- se considera la ausencia de los dos grupos OH enlazados a los cabezales de boro de los puentes B-O-B; dos OH que, junto a los dos H+ provenientes del B4O72-, suman 2 H2O, dando un total de 10 H2O (8 + 2).
– Bórax.
– Borato sódico.
– Tetraborato sódico.
– Tetraborato disódico.
Anhidro: 201,22 g/mol.
Decahidratado: 381,38 g/mol.
Un sólido blanco cristalino.
Anhidro: 2,4 g/cm3
Decahidratado: 1,739 g/cm3
Anhidro: 743 ºC (1.369 ºF, 1.016 K).
Decahidratado: 75 ºC.
Anhidro: 1.575 ºC (2.867 ºF, 1.848 K).
31,78 g/L (tanto para la anhidra como el decahidrato).
Es muy soluble en etilenglicol, moderadamente soluble en dietilenglicol y metanol, y ligeramente soluble en acetona.
Anhidro: η1 = 1,447; η2 = 1,469.
Decahidratado: η2 = 1,472.
Es estable bajo las condiciones adecuadas de almacenamiento. Aunque tiene una presión de vapor baja, esta se incrementa con la temperatura, llegando a producir cristalización y condensación, por lo que deben evitarse las fluctuaciones excesivas de la temperatura y la humedad.
El tetraborato sódico al ser sometido a la acción del fuego emite una luz verde.
– Al disolverse en el agua origina soluciones alcalinas con un pH alrededor de 9,2.
– El bórax reacciona para formar otros boratos, tales como perborato (PBS).
– También produce ácido bórico al reaccionar con el ácido clorhídrico:
Na2B4O7·10H2O + HCl => 4 H3BO3 + 2 Na+ + 2 Cl– + 5 H2O
– El tetraborato sódico se comporta como una sustancia anfótera, ya que en solución acuosa se hidroliza y es capaz de neutralizar ácidos. De la misma forma, es capaz de neutralizar los álcalis de alta concentración, evitando una elevación excesiva del pH del medio.
El bórax tiene numerosas aplicaciones, tanto en el ser humano como en el conjunto de actividades que este realiza.
El bórax tiene la capacidad de disolver los óxidos. Por esta razón es usado en la recuperación de metales como latón, cobre, plomo y cinc.
También es usado para prevenir la oxidación de las barras de metales en las fundiciones. El bórax recubre su superficie, excluyendo el aire, y por lo tanto, evitando la oxidación. Además, previene la corrosión del material ferroso en la manufactura de los automóviles.
La solubilidad del bórax en etilenglicol ha sido de utilidad en las formulaciones anticongelantes. El bórax neutraliza los residuos ácidos que se producen durante la descomposición del etilenglicol, minimizando la oxidación que pueden sufrir la superficie de los metales.
– El bórax es parte de una formulación adhesiva de almidón para papel corrugado y cartón.
– Es un agente peptizante en la manufactura de adhesivos basados en la caseína y la dextrina.
– Actúa fortaleciendo los materiales adhesivos mediante el entrecruzamiento de los grupos hidroxilos conjugados.
Se usa como retardante del fuego en los materiales celulósicos y en otros polímeros que contienen grupos hidroxilos. Ejerce su acción a través de varios mecanismos, entre ellos, la formación de una capa vítrea que limita el acceso de los combustibles.
El bórax es una fuente de boro utilizado en la elaboración del vidrio borosilicado; caracterizado por un punto de fusión elevado, bajo coeficiente de expansión y alta resistencia a los choques térmico.
Esto le permite ser sometido a altas temperaturas sin que experimente fracturas, recibiendo la denominación de vidrio refractario.
El vidrio borosilicado es utilizado en la elaboración de materiales para ser usado en el hogar para hornear alimentos. También se usa en los laboratorio en vasos de precipitados, fiolas, cilindros de medidas, pipetas, etc.
El bórax, junto con otros compuestos, se emplea para emulsionar los jabones y otras parafinas. También es usado como base para la elaboración de lociones, cremas y pomadas.
– Es agregado en las formulaciones para limpiar superficies firmes como la de metales, vidrios y cerámica.
– Se usa en limpiadores de mano, material de pulido y jabones detergentes de uso en las lavanderías y en el hogar. Además, facilita la remoción de depósitos aceitosos de los pisos de las fábricas.
– Se usa en el tratamiento de infecciones con hongos en los pies.
– Forma parte de la fórmula de nutrientes que suministran boro. Este elemento se piensa que interviene en el metabolismo del calcio, fósforo y magnesio, pudiendo ser necesario para la estructura ósea.
– Interviene en la determinación de la hemoglobina glicosilada (HbA1C), prueba que sirve para conocer el desenvolvimiento de la diabetes a largo plazo en un paciente, ya que el tiempo de vida media de un eritrocito es de 120 días.
Esta información es más útil para el médico que las determinaciones aisladas de la glucemia del paciente.
Se usa en varios sistemas amortiguadores de pH usados en bioquímica; entre ellos, el Tris(hidroximetil)aminometano-borato, usado en la electroforesis en poliacrilamida de los ácidos nucleicos DNA y RNA.
El bórax es capaz de combinarse con los iones calcio y magnesio presentes en el agua, disminuyendo su concentración. De esta manera se reduce la dureza del agua.
El bórax es utilizado como fuente de boro. El calcio y el boro intervienen en la formación de la pared celular de las plantas. Además, se ha señalado que el boro favorece la polinización, por lo que interviene en la fertilización y proliferación de las plantas.
El bórax combate la carcoma, coleóptero que consume y destruye la madera. Asimismo, se utiliza en la conservación y mantenimiento de los barcos de madera.
Se usa como fundente en la soldadura de acero y hierro, provocando una disminución del punto de fusión y la eliminación del óxido de hierro; un contaminante indeseable. Con un fin semejante, participa en la soldadura del oro y la plata.
– Se usa como un pesticida suave; por ejemplo, para el combate de las polillas en la lana.
– Pulverizado sirve para el control de plagas presentes en armarios, depósitos internos, en los huecos de las paredes, y en general, donde no se desea el uso de plaguicidas más contaminantes.
– Se utiliza en los reactores nucleares para controlar reacciones que pudieran producir, en casos extremos, una reacción en cadena.
– En los radiadores de los automóviles el bórax se usa para obturar los sitios donde hay escapes de agua.
Se obtiene el bórax haciendo reaccionar el mineral ulexita, compuesto por los elementos boro, sodio y calcio, de fórmula NaCaB5O9.8H2O, con carbonato de sodio e hidrocarbonato de sodio en medio acuoso.
En realidad, se usa poco la síntesis del tetraborato de sodio o bórax; la mayor parte del compuesto producido es obtenido por su extracción de los minerales que lo contienen.
El proceso se puede resumir en una disolución de la mena en agua, seguida de una filtración en arcilla y finalmente una evaporación de la disolución acuosa.
El bórax es un producto natural, sin embargo, puede producir una serie de daños para la salud en el ser humano. Por ejemplo, por el contacto con el polvo de bórax, se puede producir una irritación de la piel que pudiera ocasionar una dermatitis.
Igualmente, el bórax produce irritación de los ojos y del tracto respiratorio superior. Entre los síntomas de su inhalación, se encuentran la tos y el dolor de garganta.
Mientras, la ingesta de bórax presenta los siguientes síntomas: vómitos, náuseas, diarrea, flacidez, dolor de cabeza y convulsiones. Además, se puede producir una afectación del sistema nervioso central y del funcionamiento renal.
A partir de estudios realizados en ratas del sexo masculino, alimentadas con bórax, se observó en ellas atrofia testicular. Mientras que los estudios realizados con ratas del sexo femenino embarazadas señalaron que el bórax podía atravesar la placenta, produciendo una alteración del desarrollo fetal, manifestada por un bajo peso al nacer.
Se cree que la exposición al bórax puede afectar la función reproductiva masculina en el hombre, manifestada por una reducción en el conteo de los espermatozoides.
Se estima un dosis fatal de 10 a 25 gramos para la ingesta de bórax en las personas adultas.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- National Center for Biotechnology Information. (2019). Argon. PubChem Database. CID=23968. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Karolyn Burns, Seneca Joseph, & Dr. Ryan Baumbach. (s.f.). Synthesis and Properties of Borax Crystals and Intermetallic Alloys. Recuperado de: nationalmaglab.org
- Wikipedia. (2019). Borax. Recuperado de: en.wikipedia.org
- Rio Tinto. (2019). Borax decahidrate. 20 Mule Team Borax. Recuperado de: borax.com
- Fletcher Jenna. (14 de enero de 2019). Is bórax safe to use? Recuperado de: medicalnewstoday.com
