Ácido disulfúrico: estructura, propiedades, nomenclatura y usos
El ácido disulfúrico es uno de los tantos oxoácidos de azufre, cuya fórmula química es H2S2O7. La fórmula deja indicado explícitamente que hay dos átomos de azufre, y como su nombre también señala, debe haber dos moléculas de H2SO4 en una sola; sin embargo, hay siete oxígenos en lugar de ocho, por lo que un azufre debe tener tres.
Este ácido se haya como uno de los principales componentes del óleum (o ácido sulfúrico fumante), el cual viene a ser una forma “densa” del ácido sulfúrico. Tal es así su predominancia, que algunos consideran al óleum como un sinónimo del ácido disulfúrico; al cual además se le conoce con el nombre tradicional de ácido pirosulfúrico.

En la imagen se muestra un recipiente con óleum, con una concentración de trióxido de azufre, SO3, al 20%. Esta sustancia se caracteriza por ser aceitosa e incolora; aunque puede tornarse amarillenta o marrón dependiendo de la concentración del SO3 y de la presencia de algunas impurezas.
Lo anterior relata la participación del SO3 en el H2S2O7; es decir, una molécula de H2SO4 reacciona con una de SO3 para formar el ácido disulfúrico. Siendo entonces así, el H2S2O7 también puede escribirse como H2SO4·SO3.
Índice del artículo
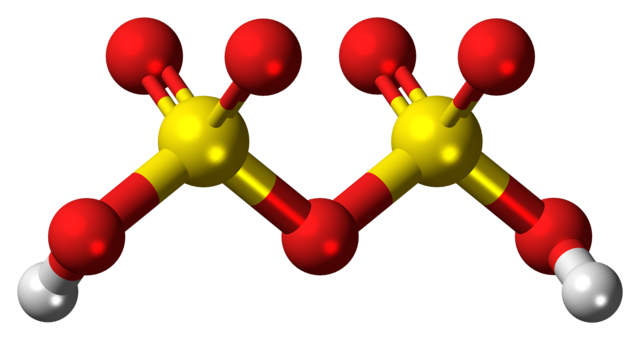
Arriba se tiene la estructura del H2S2O7 en un modelo de esferas y barras. Nótese a primera vista la simetría de la molécula: el lado izquierdo del puente de oxígeno es idéntico al derecho. Desde esa perspectiva, la estructura puede describirse con la fórmula HO3SOSO3H.
En ambos extremos se encuentran cada grupo hidroxilo, cuyo hidrógeno, por efecto inductivo de todos esos átomos de oxígeno, incrementa su carga parcial positiva; y en consecuencia, el ácido disulfúrico presenta una acidez aún más fuerte que la del ácido sulfúrico.
La molécula puede escribirse como H2SO4·SO3. Sin embargo, esto alude más a una composición del óleum que a la estructura de una molécula.
No obstante, si una molécula de agua se adiciona al H2S2O7, se liberarán dos moléculas de H2SO4:
H2S2O7 + H2O => 2H2SO4
El equilibrio puede desplazarse a la izquierda: a la formación de H2S2O7 a partir del H2SO4 si se le suministra calor. Es por esta razón que al H2S2O7 también se le conoce como ácido pirosulfúrico; ya que puede generarse tras el calentamiento del ácido sulfúrico.
Asimismo, tal como se mencionó al principio, el H2S2O7 se forma por la combinación directa del H2SO4 y SO3:
SO3 + H2SO4 => H2S2O7
Las propiedades del ácido disulfúrico no están muy bien definidas, porque es sumamente difícil aislarse de manera pura del óleum.
Debe recordarse que en el óleum pueden haber otros compuestos, con fórmulas H2SO4·xSO3, donde dependiendo del valor de x puede tenerse incluso estructuras poliméricas.
Una manera de visualizarlo es imaginar que la estructura superior del H2S2O7 se vuelve más alargada por más unidades de SO3 y puentes de oxígeno.
En un estado casi puro consiste en un sólido cristalino inestable (fumante) que funde a los 36ºC. Sin embargo, este punto de fusión puede variar dependiendo de la verdadera composición.
El ácido disulfúrico puede formar lo que se conoce como sales disulfatos (o pirosulfatos). Por ejemplo, si reacciona con el hidróxido de potasio, forma el pirosulfato de potasio, K2S2O7.
Además, se puede comentar que tiene un peso molecular de 178 g/mol, y dos equivalentes ácidos (2 iones H+ que pueden neutralizarse con una base fuerte).
Con este compuesto en forma de óleum se puede llevar a cabo una reacción curiosa: la transformación de terrones de azúcar en bloques de carbón.
El H2S2O7 reacciona con los azúcares eliminando todos sus grupos OH en forma de agua, lo cual favorece nuevas uniones entre los átomos de carbono; uniones que terminan originando carbón negro.
Al ácido disulfúrico se le considera como el anhídrido del ácido sulfúrico; es decir, pierde una molécula de agua producto de la condensación entre dos moléculas de ácido. Ante tantos nombres posibles para este compuesto, la nomenclatura IUPAC recomienda sencillamente el de ácido disulfúrico.
El término ‘piro’ alude exclusivamente a aquello formado como producto de la aplicación de calor. La IUPAC no aconseja este nombre para el H2S2O7; pero sigue siendo utilizado actualmente por muchos químicos.
La terminación –ico permanece invariable ya que el átomo de azufre continúa manteniendo una valencia de +6. Por ejemplo, puede calcularse mediante la siguiente operación aritmética:
2H + 2S + 7O = 0
2(+1) + 2S + 7(-2) = 0
S= 6
El ácido disulfúrico, dada su propiedad de solidificarse como óleum, es capaz de disolver y almacenar de forma más segura ácido sulfúrico. Esto se debe a que el SO3 escapa creando una “neblina” irrespirable, la cual es mucho más soluble en H2SO4 que en agua. Para obtener el H2SO4, bastaría adicionar al óleum agua:
H2S2O7 + H2O => 2H2SO4
A partir de la ecuación anterior, el H2SO4 se diluye en el agua adicionada. Por ejemplo, si se tiene una disolución acuosa de H2SO4, donde el SO3 tiende a escapar y representa un riesgo para los trabajadores, al adicionar óleum a la disolución este reacciona con el agua formando más ácido sulfúrico; es decir, aumentando su concentración.
Si queda algo de agua, se adiciona más SO3, el cual reacciona con el H2SO4 para producir más ácido disulfúrico u óleum, y después este vuelve a hidratarse “secando” el H2SO4. El proceso se repite las veces suficientes hasta obtener ácido sulfúrico a una concentración del 100%.
Un proceso similar se utiliza para la obtención del ácido nítrico al 100%. Asimismo, se ha utilizado para deshidratar otras sustancias químicas, empleadas para la elaboración de explosivos.
Se usa para sulfonar estructuras, como las de los colorantes; es decir, adiciona grupos –SO3H, los cuales al perder su protón ácido puede anclarse al polímero de la fibra textil.
Por otro lado, la acidez del óleum se aprovecha para lograr la segunda nitración (adicionar grupos –NO2) a los anillos aromáticos.
- Shiver & Atkins. (2008). Química Inorgánica. (cuarta edición). Mc Graw Hill.
- Wikipedia. (2018). Disulfuric acid. Recuperado de: en.wikipedia.org
- PubChem. (2019). Pyrosulfuric acid. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Seong Kyu Kim, Han Myoung Lee, & Kwang S. Kim. (2015). Disulfuric acid dissociated by two water molecules: ab initio and density functional theory calculations. Phys. Chem. Chem. Phys., 2015, 17, 28556
- Contra Costa Health Services. (s.f.). Oleum/sulfur trioxide: chemical fact sheet. [PDF]. Recuperado de: cchealth.org
