Grupo carbonilo: características, propiedades, nomenclatura, reactividad
El grupo carbonilo es un grupo funcional orgánico y oxigenado que se asemeja a la molécula gaseosa de monóxido de carbono. Se representa como C=O, y aunque se considera orgánico, puede encontrársele también en compuestos inorgánicos; como el ácido carbónico, H2CO3, o en compuestos organometálicos con el CO como ligante.
No obstante, es en la química del carbono, de la vida, bioquímica y otras análogas ramas científicas en donde este grupo destaca por su enorme importancia. Si no fuera por él, muchas moléculas no podrían interactuar con el agua; las proteínas, azúcares, aminoácidos, grasas, los ácidos nucleicos y otras biomoléculas no existirían de no ser por él.
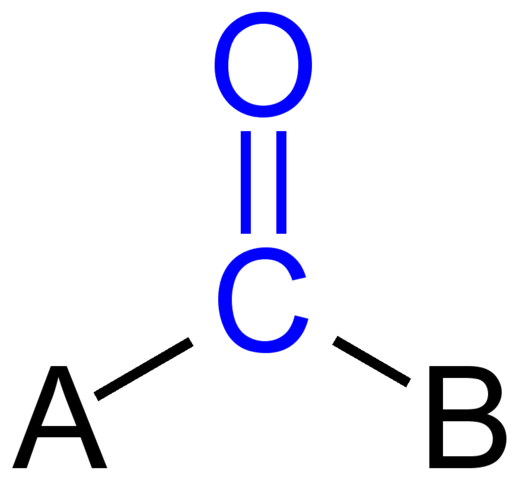
En la imagen superior se muestra cómo luce este grupo en el esqueleto general de un compuesto. Nótese que está resaltado por el color azul, y si retirásemos los sustituyentes A y B (R o R’, igualmente válidos), quedaría una molécula de monóxido de carbono. La presencia de estos sustituyentes define un número grande de moléculas orgánicas.
Si A y B son átomos distintos al carbono, como metales o elementos no metálicos, puede tenerse compuestos organometálicos o inorgánicos, respectivamente. En el caso de la química orgánica, los sustituyentes A y B siempre van a ser o átomos de hidrógeno, cadenas carbonadas líneas, con o sin ramificaciones, cíclicas, o anillos aromáticos.
Es así que empieza comprenderse por qué el grupo carbonilo es bastante común para quienes estudian ciencias naturales o de la salud; está en todas partes, y sin él los mecanismos moleculares que suceden en nuestras células no ocurrirían.
Si se pudiera resumir su relevancia se diría que aporta polaridad, acidez y reactividad a una molécula. Donde haya un grupo carbonilo, es más que probable que justo en ese punto la molécula pueda sufrir una transformación. Por lo tanto, es un sitio estratégico para desarrollar síntesis orgánicas a través de oxidaciones o ataques nucleofílicos.
Índice del artículo
- 1 Características y propiedades del grupo carbonilo
- 2 Nomenclatura
- 3 Reactividad
- 4 Tipos
- 5 Cómo identificarlo en aldehídos y cetonas
- 6 Principales ejemplos
- 7 Referencias
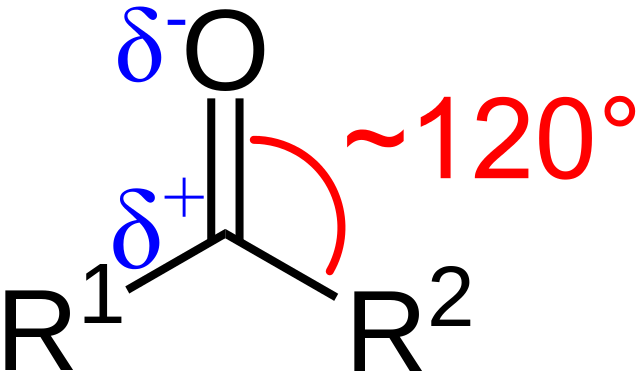
¿Cuáles son las características estructurales y electrónicas del grupo carbonilo? Arriba puede apreciarse, ahora utilizando las letras R1 y R2 en lugar de A y B, que existe entre los sustituyentes y el átomo de oxígeno un ángulo de 120°C; es decir, que la geometría entorno a este grupo es plano trigonal.
Para que tal sea la geometría los átomos de carbono y oxígeno necesariamente deben tener hibridación química sp2; así, el carbono tendrá tres orbitales sp2 para formar enlaces covalentes simples con R1 y R2, y un orbital p puro para establecer el doble enlace con el oxígeno.
De esta manera se explica cómo puede haber un doble enlace C=O.
Si se observa la imagen se verá además que el oxígeno presenta mayor densidad electrónica, δ-, que el carbono, δ+. Esto se debe a que el oxígeno es más electronegativo que el carbono, y por tanto le “roba” densidad electrónica; y no sólo a él, sino inclusive también a los sustituyentes R1 y R2.
En consecuencia, se genera un momento dipolar permanente, el cual puede ser de mayor o menor magnitud dependiendo de la estructura molecular. Adonde haya un grupo carbonilo, habrá momentos dipolares.
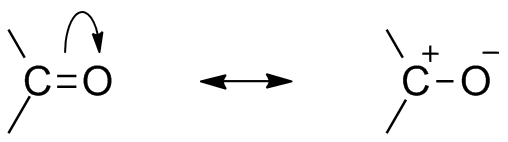
Otra consecuencia de la electronegatividad del oxígeno es que en el grupo carbonilo haya estructuras de resonancia que definen un híbrido (la combinación de las dos estructuras de la imagen superior). Nótese que el par de electrones puede migrar hacia el orbital p del oxígeno, lo cual deja al átomo de carbono con una carga parcial positiva; un carbocatión.
Ambas estructuras se suceden constantemente, por lo que el carbono mantiene una deficiencia constante de electrones; es decir, que para los cationes que estén muy cerca de él experimentarán una repulsión electrostática. Pero, si se trata de un anión, o una especie capaz de donar electrones, sentirá una atracción fuerte por este carbono.
Entonces ocurre lo que se conoce como el ataque nucleofílico, lo cual se explicará en un próximo apartado.
Cuando un compuesto posee el grupo C=O, se dice que es carbonílico. Así, dependiendo de la naturaleza del compuesto carbonílico, este posee sus propias reglas de nomenclatura.
Aunque, sin importar cuál sea, todos comparten una regla en común: el C=O tiene prioridad en la cadena carbonada al momento de enumerar los átomos de carbono.
Esto significa que si hay ramificaciones, átomos de halógenos, grupos funcionales nitrogenados, dobles o triples enlaces, ninguno de ellos puede llevar un número localizador menor que el C=O; por lo tanto, se empieza a enumerar la cadena más larga lo más cercano posible al grupo carbonilo.
Si por el contrario hay varios C=O en la cadena, y uno de ellos forma parte de un grupo funcional de mayor jerarquía, entonces el grupo carbonilo llevará un localizador mayor y se mencionará como un sustituyente oxo.
¿Y cuál es dicha jerarquía? La siguiente, de mayor a menor:
-Ácidos carboxílicos, RCOOH
-Éster, RCOOR’
-Amida, RCONH2
-Aldehído, RCOH (o RCHO)
-Cetona, RCOR
Sustituyendo R y R’ por segmentos moleculares, se originan un sinfín de compuestos carbonílicos representados por las familias de arriba: ácidos carboxílicos, ésteres, amidas, etc. Cada uno tiene asociado su nomenclatura tradicional o IUPAC.
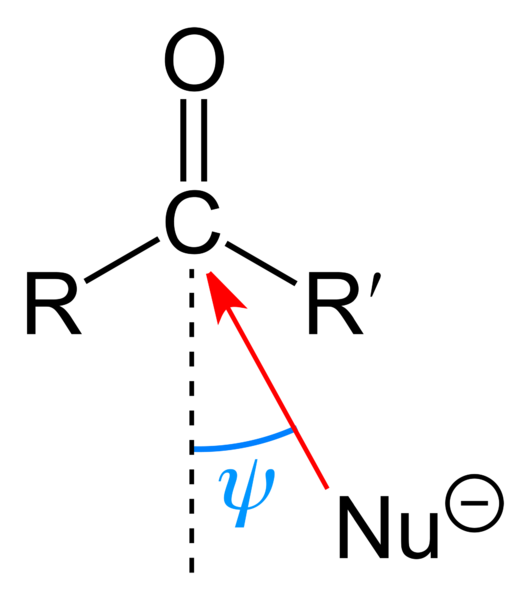
En la imagen superior se muestra el ataque nucleofílico que sufre el grupo carbonilo. El nucleófilo, Nu–, puede ser un anión o una especie neutra con pares de electrones disponibles; como el amoníaco, NH3, por ejemplo. Este busca exclusivamente al carbono porque, de acuerdo a las estructuras de resonancia, presenta una carga parcial positiva.
La carga positiva atrae a Nu–, el cual buscará aproximarse por un “flanco” tal que haya el menor impedimento estérico por parte de los sustituyentes R y R’. Dependiendo de cuán voluminosos sean, o del tamaño del mismo Nu–, el ataque ocurrirá a diferentes ángulos ψ; puede ser muy abierto o cerrado.
Una vez que suceda el ataque, se formará un compuesto intermediario, Nu-CRR’-O–; es decir, el oxígeno se queda con un par de electrones para permitir que se adicione Nu– al grupo carbonilo.
Este oxígeno cargado negativamente puede intervenir en otros pasos de la reacción; protonarse como grupo hidroxilo, OH, o liberarse como una molécula de agua.
Los mecanismos implicados, así como los productos de la reacción obtenidos por este ataque, son muy variados.
Derivados
El agente nucleofílico Nu– puede tratarse de muchas especies. Para cada uno en específico al reaccionar con el grupo carbonilo origina distintos derivados.
Por ejemplo, cuando dicho agente nucleofílico es una amina, NH2R, se originan iminas, R2C=NR; si es la hidroxilamina, NH2OH, da lugar a las oximas, RR’C=NOH; si es el anión cianuro, CN–, se producen cianohidrinas, RR’C(OH)CN, y así con otras especies.
Al principio se dijo que este grupo está oxigenado, y por lo tanto, oxidado. Esto significa que, dadas las condiciones, puede reducirse o perder enlaces con el átomo de oxígeno reemplazándolo con hidrógenos. Por ejemplo:
C=O => CH2
Esta transformación indica que el grupo carbonilo se redujo a un grupo metileno; hubo ganancia de hidrógeno a raíz de la pérdida del oxígeno. En términos químicos más apropiados: el compuesto carbonílico se reduce a un alcano.
Si se trata de una cetona, RCOR’, en presencia de hidracina, H2N-NH2, y un medio fuertemente básico puede reducirse a su respectivo alcano; esta reacción se conoce como reducción de Wolff-Kishner:
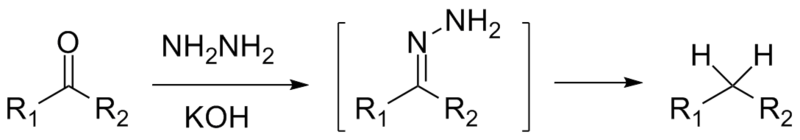
Si por otro lado la mezcla de reacción consiste de zinc amalgamado y ácido clorhídrico, la reacción se conoce como reducción de Clemmensen:
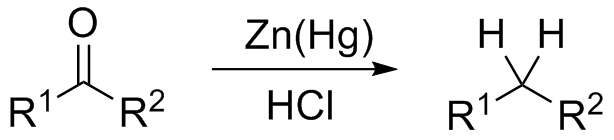
El grupo carbonilo no solo puede adicionar agentes nucleofílicos Nu–, sino que en condiciones ácidas puede reaccionar además con los alcoholes mediante mecanismos similares.
Cuando un aldehído o cetona reaccionan parcialmente con un alcohol, se originan hemiacetales o hemicetales, respectivamente. Si la reacción se lleva a cabo completamente, los productos son acetales y cetales. Las siguientes ecuaciones químicas resumen y aclaran mejor lo recién mencionado:
RCHO + R3OH g RCHOH(OR3) (Hemiacetal) + R4OH g RCH(OR3)(OR4) (Acetal)
RCOR2 + R3OH g RCOR2(OH)(OR3) (Hemicetal) + R4OH g RCOR2(OR3)(OR4) (cetal)
La primera reacción corresponde a la formación de hemiacetales y acetales a partir de un aldehído, y la segunda de hemicetales y cetales a partir de una cetona.
Estas ecuaciones quizás no sean lo suficientemente sencillas para explicar la formación de estos compuestos; sin embargo, para un primer acercamiento al tema basta con entender que los alcoholes se adicionan, y que sus cadenas laterales R (R3 y R4) pasan a enlazarse al carbono carbonílico. Es por eso que se adicionan OR3 y OR4 a la molécula inicial.
La principal diferencia entre un acetal y cetal, es la presencia del átomo de hidrógeno enlazado al carbono. Nótese que la cetona carece de este hidrógeno.
Muy similar como se explicó en el apartado de nomenclatura para el grupo carbonilo, sus tipos están en función de cuáles son los sustituyentes A y B, o R y R’. Por lo tanto, existen características estructurales que comparten una serie de compuestos carbonílicos más allá que sólo el orden o tipo de enlaces.
Por ejemplo, se hizo mención al principio de la analogía entre este grupo y el monóxido de carbono, C≡O. Si la molécula está desprovista de átomos de hidrógeno y si además hay dos C=O terminales, se tratará entonces de un óxido de carbono, CnO2. Para n igual a 3, se tendrá:
O=C=C=C=O
Que es como si hubiera dos moléculas de C≡O unidas y separadas por un carbono.
Los compuestos carbonílicos no sólo pueden derivar del gas CO, sino también del ácido carbónico, H2CO3 o OH-(C=O)-OH. Aquí los dos OH representan a R y R’, y reemplazando bien sea a uno de ellos, o a sus hidrógenos, se obtienen derivados del ácido carbónico.
Y luego están los derivados de ácidos carboxílicos, RCOOH, obtenidos al cambiar las identidades de R, o sustituir H por otro átomo o cadena R’ (lo cual daría lugar a un éster, RCOOR’).
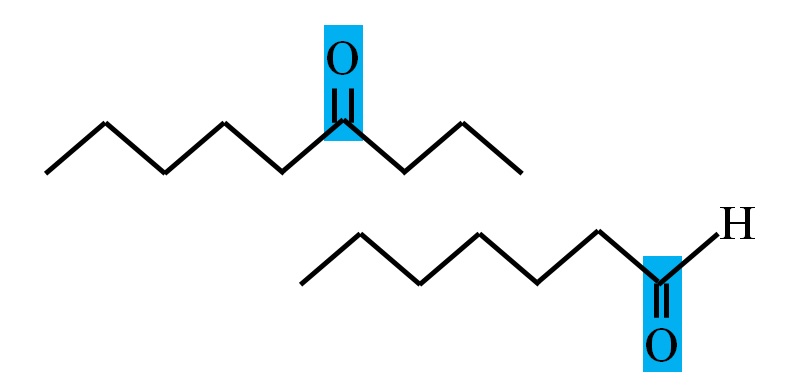
Tanto los aldehídos como las cetonas tienen en común la presencia del grupo carbonilo. Sus propiedades químicas y físicas se deben a él. Sin embargo, sus entornos moleculares no son iguales en ambos compuestos; en los primeros se halla en una posición terminal, y en los segundos, en cualquier lugar de la cadena.
Por ejemplo, en la imagen superior el grupo carbonilo está dentro de un recuadro azulado. En las cetonas, al lado de este recuadro tiene que haber otro carbono o segmento de cadena (parte de arriba); mientras que en los aldehídos, solamente puede haber un átomo de hidrógeno (parte de abajo).
Si el C=O está en un extremo de la cadena, se tratará de un aldehído; esa es la manera más directa para diferenciarlo de un cetona.
Pero, ¿cómo saber experimentalmente si un compuesto desconocido es un aldehído o una cetona? Existen numerosos métodos, desde espectroscópicos (absorción de radiación infrarroja, IR), o ensayos cualitativos orgánicos.
Respecto a los ensayos cualitativos, estos se fundamentan en reacciones que al dar positivas el analista observará una respuesta física; un cambio de color, liberación de calor, formación de burbujas, etc.
Por ejemplo, al adicionar a la muestra una solución ácida de K2Cr2O7 el aldehído se transformará en ácido carboxílico, lo cual hace que el color de la solución cambie de anaranjado a verde (prueba positiva). Mientras, las cetonas no reaccionan, y por ende, el analista no observa ningún cambio de color (prueba negativa).
Otro ensayo consiste de utilizar el reactivo de Tollens, [Ag(NH3)2]+, para que el aldehído reduzca los cationes Ag+ a plata metálica. Y el resultado: la formación de un espejo de plata en el fondo del tubo de ensayo donde se colocó la muestra.
Para finalizar se enlistarán una serie de ejemplos de compuestos carbonílicos:
-CH3COOH, ácido acético
-HCOOH, ácido fórmico
-CH3COCH3, propanona
-CH3COCH2CH3, 2-butanona
-C6H5COCH3, acetofenona
-CH3CHO, etanal
-CH3CH2CH2CH2CHO, pentanal
-C6H5CHO, benzaldehído
-CH3CONH2, acetamida
-CH3CH2CH2COOCH3, acetato de propilo
Ahora bien, de citarse ejemplos de compuestos que simplemente poseen este grupo, la lista se haría casi interminable.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Reid Danielle. (2019). Carbonyl Group: Properties & Overview. Study. Recuperado de: study.com
- Sharleen Agvateesiri. (05 de junio de 2019). The Carbonyl Group. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Wiki Kids Ltd. (2018). Carbonyl compounds. Recuperado de: simply.science
- Toppr. (s.f.). Nomenclature and Structure of Carbonyl Group. Recuperado de: toppr.com
- Clark J. (2015). Oxidation of aldehydes and ketones. Recuperado de: chemguide.co.uk
