Transesterificación: mecanismo, en ácidos grasos, en microalgas, usos
La transesterificación es una reacción química que experimentan los ésteres. El grupo alcoxi del éster es remplazado por otro usualmente bajo condiciones ácidas o básicas. Este tipo de reacciones se llevan a cabo mediante un mecanismo idéntico al de la hidrólisis del éster. Sin embargo, ocurre con frecuencia que la transesterificación no se lleve a cabo cuando el alcohol es terciario.
Debido a que se trata de una reacción en equilibrio, esta debe desplazarse hacia la dirección deseada empleando un exceso considerable del alcohol que se desea que esté presente en la estructura final o eliminando el otro.
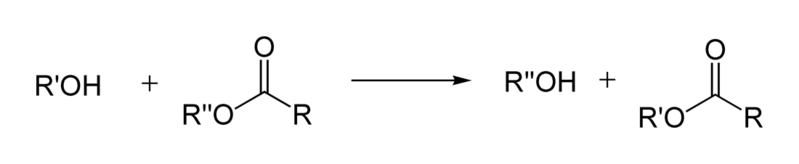
El hecho de que el equilibrio de la reacción sea reversible, con mecanismos equivalentes para las reacciones directa e inversa, implica que la transesterificación se muestra como el ejemplo más apropiado para iniciar el estudio de los mecanismos de sustitución nucleofílica en el grupo acilo cuando es catalizada por un ácido o por una base.
Índice del artículo
- 1 Mecanismo de transesterificación
- 2 Transesterificación de ácidos grasos
- 3 Transesterificación en microalgas
- 4 Aplicaciones de la transesterificación
- 5 Referencias
Las reacciones de transesterificación, por lo general, son catalizadas por ácidos o por bases.
Cuando se utiliza una base como catalizador el mecanismo de la reacción implica una sustitución nucleofílica sencilla en el grupo acilo que se divide en dos pasos: la adición del nucleófilo y la eliminación del grupo saliente.
En el caso de la transesterificación catalizada por un ácido, la reacción también se divide en los dos pasos nombrados anteriormente, pero se requiere una transferencia de protones antes y después de cada uno de estos.
Es decir, el ataque nucleofílico del alcohol es precedido por la protonación del grupo carbonilo y, después de que se lleva a cabo, es necesario que ocurra la desprotonación. De manera similar, la eliminación del grupo saliente es precedida por la protonación de este y, una vez culmina la etapa de eliminación, ocurre nuevamente la desprotonación.
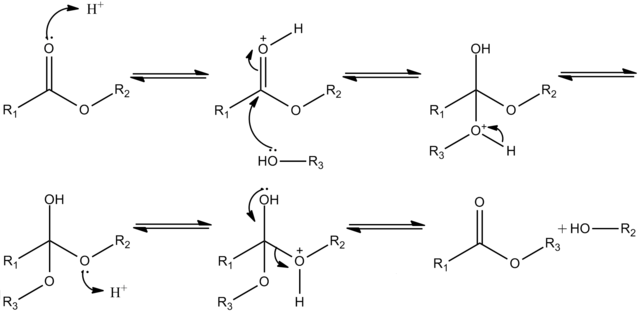
Debido a que el mecanismo anterior puede generar la formación de ácidos carboxílicos mediante la reacción del carbocatión (producto de la protonación del grupo carbonilo) con agua presente en el medio de reacción, las reacciones de transesterificación catalizadas por ácido se deben llevar a cabo en ausencia de agua.
En algunos casos, la transesterificación puede llevarse a cabo en un medio no catalítico. Sin embargo, esto solo es posible en condiciones supercríticas (mayor temperatura y mayor presión), lo que no es viable económicamente.
Los aceites vegetales, provenientes de semillas y frutos de las plantas, están constituidos principalmente por triglicéridos (triésteres del glicerol) que incluyen tres ácidos grasos de cadena larga responsables de la alta masa molecular y la baja volatilidad de tales aceites.
Al someterlos a un proceso de transesterificación utilizando metanol, los aceites son convertidos en los ésteres de metilo de los tres ácidos grasos individuales. El glicerol también se genera como un subproducto de la reacción.
Además del metanol, en la transesterificación de ácidos grasos suelen usarse otros alcoholes de cadena corta como etanol, propanol, butanol y pentanol. Sin embargo, el metanol y etanol son los de preferencia:
- El metanol debido a sus propiedades fisicoquímicas particulares.
- El etanol porque es menos tóxico y puede producirse a partir de fuentes renovables.
Los catalizadores utilizados en la reacción pueden ser ácidos o básicos. Sin embargo, es frecuente que el proceso se lleve a cabo en un medio alcalino, debido a que la eficiencia de la reacción es mayor y, además, se generan menos daños en los equipos utilizados como resultado de la corrosión.
Debido a que las masas moleculares de los ésteres de metilo obtenidos son de aproximadamente un tercio de la masa molecular del triglicérido original, su volatilidad es mayor y pueden ser utilizados en motores diésel.
Por lo tanto, la mezcla de ésteres de metilo obtenida a partir de los ácidos grasos suele recibir el nombre de biodiésel. Sin embargo, su composición dependerá de la estructura de las cadenas de ácido carboxílico que forman cada triglicérido.
Los triglicéridos también se pueden obtener a partir de microalgas. Estas especies no solo los sintetizan de manera natural, sino que también los almacenan como una reserva de energía de carbono dentro de sus células cuando ya no pueden dividirse.
Con respecto a los aceites vegetales, las microalgas ofrecen varias ventajas cuando se trata de su uso como materia prima para obtener biodiésel. Además de producir una mayor cantidad de biomasa debido a que exhiben altas tasas de crecimiento, no representan una competencia para las áreas de cultivo destinadas a la producción de alimentos.
Las microalgas pueden crecer en condiciones tan adversas como las encontradas en tierras no cultivables o cuerpos de agua dulce y salada como estanques, lagos, mares y océanos.

Debido a que el aceite de microalgas contiene más ácidos grasos libres que los aceites vegetales, lo que produce reacciones secundarias adversas en medio básico, se debería llevar a cabo un proceso de esterificación utilizando catalizadores ácidos antes de la transesterificación habitual.
Ante esto, los catalizadores sólidos se presentan con un gran potencial en la transesterificación de microalgas. Además de que se pueden utilizar varias veces y separar fácilmente del medio de reacción, se obtiene glicerol puro sin subproductos, pues el proceso no es afectado por la humedad presente en las materias primas y los ácidos grasos libres.
La transesterificación se utiliza principalmente en la producción de biodiésel; no solo se obtienen beneficios económicos, sino que se reducen las emisiones de gases de efecto invernadero. Sin embargo, la gran versatilidad de la transesterificación ha permitido su uso tanto en el laboratorio como en la industria.
Cuando se trata de la síntesis de ésteres, la transesterificación suele tener más ventajas que el uso de ácidos carboxílicos y alcoholes en ciertos casos particulares.
Los ésteres son solubles en la mayoría de los solventes orgánicos, mientras que algunos ácidos carboxílicos tienen una solubilidad muy reducida, lo que dificulta llevar a cabo una esterificación homogénea. Entonces resulta particularmente útil la transformación éster-éster a partir de ésteres metílicos y etílicos disponibles comercialmente.
La transesterificación también es útil en la apertura del anillo de lactonas que da lugar a la formación de un poliéster.
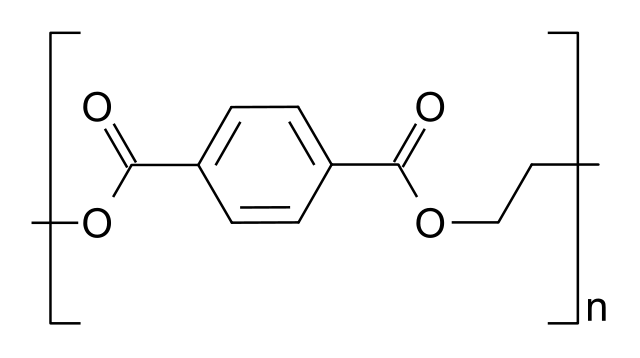
Aunque en la actualidad la producción de tereftalato de polietileno (PET, por sus siglas en inglés) está basada casi en su totalidad en la esterificación directa del ácido tereftálico, solía utilizarse la reacción de transesterificación entre el tereftalato de dimetilo y el etilenglicol en la producción de este poliéster.
Por otra parte, la transesterificación es fundamental en la industria de las pinturas, pues el curado (poliesterificación) de resinas alquídicas permite mejorar las propiedades de las pinturas en las que se utilizan aceites vegetales como materia prima.
- Da Silva, V. T., & Sousa, L. A. (2013). Catalytic Upgrading of Fats and Vegetable Oils for the Production of Fuels. The Role of Catalysis for the Sustainable Production of Bio-Fuels and Bio-Chemicals, 67–92.
- Makareviciene, V., & Skorupskaite, V. (2019). Transesterification of microalgae for biodiesel production. Second and Third Generation of Feedstocks, 469–510.
- Meneghetti, S. P., Meneghetti, M. R., & Brito, Y. C. (2013). Transesterification, Some Applications and Biodiesel Production. Revista Virtual de Química, 5(1), 63-73.
- Nasreen, S., Nafees, M., Qureshi, L. A., Asad, M. S., Sadiq, A., & Ali, S. D. (2018). Review of catalytic transesterification methods for biodiesel production (pp. 93-119). IntechOpen.
- Schuchardt, U., Sercheli, R., & Vargas, R. M. (1998). Transesterification of vegetable oils: a review. Journal of the Brazilian Chemical Society, 9(3), 199-210.
- Smith, M. B. (2020). March’s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (8th ed.). Hoboken: John Wiley & Sons.
- Vyas, A. P., Verma, J. L., & Subrahmanyam, N. (2010). A review on FAME production processes. Fuel, 89(1), 1–9.
- Wade, L. G. (2013). Organic Chemistry (8thed.). New York. Pearson.
