Información y Ejemplos
Tabla Periódica
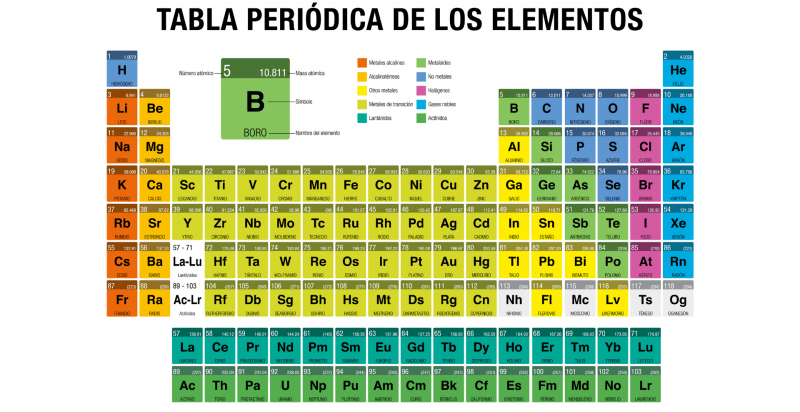
La Tabla Periódica de los elementos es una tabla en la que se encuentran dispuestos todos los elementos químicos conocidos por el hombre, ordenados según su número atómico (cantidad de protones), configuración de electrones y propiedades químicas específicas.
Se trata de una herramienta conceptual fundamental para el estudio de la materia cuya primera versión fue publicada en 1869 por el químico ruso Dmitri Mendeléyev, y que se ha actualizado con el pasar de los años, conforme se han descubierto nuevos elementos químicos y se han comprendido mejor los patrones subyacentes a sus propiedades.
La tabla periódica actual está estructurada en siete filas (horizontales) denominadas períodos y en 18 columnas (verticales) llamadas grupos o familias. Los elementos químicos se ordenan de acuerdo a sus propiedades de izquierda a derecha a lo largo de los períodos y de arriba hacia abajo siguiendo cada grupo.
Algunas propiedades de los elementos químicos, como el radio atómico y el radio iónico, aumentan desde arriba hacia abajo (siguiendo el grupo) y de derecha a izquierda (siguiendo el período), mientras que la energía de ionización, la afinidad electrónica y la electronegatividad aumentan desde abajo hacia arriba (siguiendo el grupo) y de izquierda a derecha (siguiendo el período).

![]()
![]() Puede servirte: Compuestos orgánicos e inorgánicos
Puede servirte: Compuestos orgánicos e inorgánicos
Grupos de la Tabla periódica
Numerados del 1 al 18 de izquierda a derecha, los nombres actuales de los grupos están determinados por la nomenclatura IUPAC, aprobada en 1988 para unificar las diversas formas de nombre que existían. Los elementos integrantes de cada grupo tienen configuraciones electrónicas semejantes y la misma valencia (cantidad de electrones en la última órbita), por lo que tienen propiedades químicas semejantes.
Según IUPAC, existen los siguientes grupos de elementos:
- Grupo 1 (IA). En este grupo están todos metales alcalinos, con excepción del hidrógeno, que si bien está nominalmente en el grupo, es un gas. Forman parte de la familia los elementos: litio (Li), Sodio (Na), potasio (K), rubidio (Rb), cesio (Cs), francio (Fr). Poseen muy bajas densidades, son buenos transmisores del calor y la electricidad, y jamás se los encuentra libremente en la naturaleza, sino en compuestos con otros elementos.
- Grupo 2 (IIA). En este grupo están los llamados metales alcalinotérreos, son más duros que los alcalinos, brillantes y buenos conductores eléctricos, aunque menos reactivos y muy buenos reductores (oxidantes). La familia se compone de: berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra).
- Grupo 3 (IIIB). En este grupo está la familia del escandio, si bien en muchos de los grupos del bloque “d” de la tabla (grupos del 3 al 12, incluidos los actínidos y las tierras raras) no hay consenso definitivo respecto al ordenamiento ideal. Componen esta familia: el escandio (Sc), itrio (Y), lantano o lutecio (La) y actinio (Ac), son sólidos, brillantes y altamente reactivos, semejantes en propiedades al aluminio. A este grupo pertenecen también las llamadas “Tierras raras”: los lantánidos (o lantanoides). También pertenecen a este grupo los actínidos (o actinoides). Ambos conjuntos de elementos (los lantánidos y actínidos) se denominan “elementos de transición interna” y están en un bloque inferior de la tabla. Los lantánidos son: lantano (La), cerio (Ce), praseodimio (Pr), neodimio (Nd), prometio (Pm), samario (Sm), europio (Eu), gadolinio (Gd), terbio (Tb), disprosio (Dy), holmio (Ho), erbio (Er), tulio (Tm), Iterbio (Yb), lutecio (Lu). Los actínidos son: actinio (Ac), torio (Th), protactinio (Pa), uranio (U), neptunio (Np), plutonio (Pu), americio (Am), curio (Cm), berkelio (Bk), californio (Cf), einstenio (Es), fermio (Fm), mendelevio (Md), nobelio (No) y lawrencio (Lr). A partir del neptunio en adelante se trata de isótopos inestables creados por el hombre.
- Grupo 4 (IVB). En este grupo está la llamada “familia del titanio”, compuesta por los elementos titanio (Ti), circonio (Zr), hafnio (Hf) y rutherfordio (Rf), este último sintético y radiactivo, por lo que a veces no es tomado en cuenta. Se trata de metales muy reactivos, por lo que en ciertas presentaciones pueden enrojecer e inflamarse al instante con tan solo entrar en contacto con el oxígeno del aire.
- Grupo 5 (VB). En este grupo está la familia del vanadio (V), encabezada por el vanadio (V) y acompañado por el niobio (Nb), tántalo (Ta) y dubnio (Db), este último de producción exclusiva en los laboratorios. Son sólidos a temperatura ambiente, de color plateado y conducen el calor y la electricidad.
- Grupo 6 (VIB). En este grupo está la familia del cromo (Cr), integrada por el cromo (Cr), el molibdeno (Mo), wolframio (W) y seaborgio (Sg). Son sólidos de alto punto de fusión y ebullición, conductores del calor y la electricidad, muy resistentes a la corrosión y bastante reactivos.
- Grupo 7 (VIIB). En esta familia se encuentran el manganeso (Mn), tecnecio (Tc) y renio (Re), así como el elemento de número atómico 107, el bohrio (Bh). Este último fue sintetizado por primera vez en 1981 y es altamente inestable, por lo que su vida media es de apenas 0,44 segundos. En líneas generales, el renio y el tecnecio también son elementos sumamente infrecuentes: el tecnecio no tiene formas estables, mientras que el manganeso es muy frecuente en la naturaleza.
- Grupo 8 (VIIIB). En este grupo está la familia del hierro (Fe), que incluye el rutenio (Ru), el osmio (Os) y el hassio (Hs). Al hassio se le conocía como unniloctio y fue sintetizado 1984 por primera vez; figura entre los controversiales elementos 101 a 109, cuya nomenclatura ha sido cuestionada. Son elementos bastante reactivos, buenos conductores de calor y electricidad y, en el caso del hierro, magnéticos.
- Grupo 9 (VIIIB). En este grupo está la familia la del cobalto (Co), que contiene los elementos cobalto (Co), rodio (Rh), iridio (Ir) y meitnerio (Mt). Al igual que en el grupo anterior, el primero es ferromagnético y representativo de las propiedades de la familia, y el último es sintético, por lo que no existe en la naturaleza (su isótopo más estable dura unos 10 años).
- Grupo 10 (VIIIB). En versiones anteriores de la Tabla Periódica, este grupo integraba una sola familia, con los grupos 8 y 9.. Versiones recientes los separaron. Este grupo es encabezado por el níquel (Ni), al que acompañan el paladio (Pd), platino (Pt) y darmstadtio (Ds). Se trata de metales comunes en la naturaleza en forma elemental, aunque el níquel (el más reactivo) puede hallarse en aleación (en algunos meteoritos, sobre todo). Sus propiedades catalíticas hacen de estos metales un suministro importante para la industria química y aeroespacial.
- Grupo 11 (IB). En este grupo está la familia del cobre (Cu), y la integran el cobre (Cu) y los metales preciosos oro (Au) y plata (Ag) y el roentgenio (Rg). También se los conoce como “metales de acuñar”. Son bastante poco reactivos, difíciles de corroer, blandos y sumamente útiles al hombre.
- Grupo 12 (IIB). Este grupo contiene la familia del cinc (Zn), que contiene el zinc, el cadmio (Cd), el mercurio (Hg) y el copernicio (Cn), antiguamente llamado ununbio. Se trata de metales blandos (de hecho, el mercurio es el único metal líquido a temperatura ambiente), diamagnéticos y divalentes, con los puntos de fusión más bajos de todos los metales de transición. Lo curioso es que el zinc es muy necesario para la química de la vida, mientras que el cadmio y el mercurio son altamente intoxicantes. El copernicio, por su parte, es un elemento sintético creado en 1996.
- Grupo 13 (IIIA). En este grupo están los elementos conocidos como “térreos”, ya que son abundantes en la tierra, sobre todo el aluminio. El grupo lo encabeza el boro (B), que es un metaloide, y luego el aluminio (Al), galio (Ga), indio (In), talio (Ta) y nihonio (Nh), cada vez más metálicos a medida que se desciende en la columna. Y si bien el boro posee alta dureza y propiedades no metálicas, los demás son metales blandos y maleables muy usados por el hombre.
- Grupo 14 (IVA). En este grupo están los elementos carbonoideos, encabezados por el carbono (C), y continuando con el silicio (Si), germanio (Ge), estaño (Sn), plomo (Pb) y flevorio (Fl). Son elementos muy conocidos, especialmente el carbono, indispensable para toda la química de la vida. A medida que se desciende en la familia, no obstante, los elementos van adquiriendo propiedades metálicas, a punto tal de que el carbono es no metálico, el silicio y germanio semimetales y los últimos claramente metálicos.
- Grupo 15 (VA). En este grupo están los elementos nitrogenoideos, encabezados por el nitrógeno (N), luego el fósforo (P), el arsénico (As), el antimonio (Sb), el bismuto (Bi) y el moscovio (Mc), un elemento sintético. También se conocen como pnicógenos o nitrogenoideos, son muy reactivos a altas temperaturas y muchos son indispensables para la química orgánica.
- Grupo 16 (VIA). En este grupo están los llamados calcógenos o anfígenos. Se trata de la familia del oxígeno (O), que contiene el oxígeno (O), seguido por el azufre (S), selenio (Se), telurio (Te), polonio (Po) y livermorio (Lv). Se caracterizan por tener seis electrones de valencia, a pesar de lo cual sus propiedades varían de no metálico a metálico según aumente su número atómico. A temperatura ambiente, el oxígeno es un gas muy reactivo debido a su pequeño tamaño, mientras el resto de los elementos son sólidos y menos frecuentes en la naturaleza.
- Grupo 17 (VIIA). En este grupo está la familia de los halógenos, nombre que proviene de su tendencia a formar sales (haluros). Esto se debe a que constituyen, por lo general, moléculas diatómicas de potencia oxidante considerable, lo que las lleva a constituir iones mononegativos. Se utilizan ampliamente en la industria química y en la fabricación de insumos para laboratorio. Estos elementos son el flúor (F), cloro (Cl), bromo (Br), yodo (I), astato (At) y teneso (Ts), siendo este último también un metal del grupo f.
- Grupo 18 (VIIIA). En este grupo están los elementos conocidos como “gases nobles” o “gases inertes”. Son elementos de bajísima reactividad, que suelen hallarse como gases monoatómicos, inodoros, incoloros, insípidos, formando poquísimos y excepcionales compuestos, debido a que su capa más externa de electrones está completa. Estos elementos son el helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), el radón (Rn) y el oganesón (Og). Estos dos últimos son particulares: el radón es radiactivo y no posee isótopos estables (su isótopo más estable es el 222Rn, que existe apenas 3,8 días), mientras que el oganesón es de origen sintético y el elemento más pesado creado hasta la fecha.
Bloques de la Tabla periódica
Otra forma de entender la Tabla Periódica es a través de sus cuatro bloques:
![]()
![]() Bloque s. Comprende los dos primeros grupos, es decir, metales alcalinos y alcalinotérreos, además del hidrógeno y el helio.
Bloque s. Comprende los dos primeros grupos, es decir, metales alcalinos y alcalinotérreos, además del hidrógeno y el helio.![]()
![]() Bloque p. Comprende los últimos seis grupos, es decir, del 13 al 18 en la Tabla Periódica y además a todos los metaloides.
Bloque p. Comprende los últimos seis grupos, es decir, del 13 al 18 en la Tabla Periódica y además a todos los metaloides.![]()
![]() Bloque d. Comprende los grupos del 3 al 12 y todos los metales de transición.
Bloque d. Comprende los grupos del 3 al 12 y todos los metales de transición.![]()
![]() Bloque f. Comprende las tierras raras (lantánidos) y actínidos. No posee números de grupo propios, aunque se asume que estos elementos pertenecerían al 3.
Bloque f. Comprende las tierras raras (lantánidos) y actínidos. No posee números de grupo propios, aunque se asume que estos elementos pertenecerían al 3.![]()
![]() Bloque g. Un bloque hipotético, en el que irían los elementos que logren sintetizarse a futuro.
Bloque g. Un bloque hipotético, en el que irían los elementos que logren sintetizarse a futuro.
Sigue con:
 Compartir en Facebook
Compartir en Facebook Twittear
Twittear
 Puede servirte:
Puede servirte:  Bloque s. Comprende los dos primeros grupos, es decir, metales alcalinos y alcalinotérreos, además del hidrógeno y el helio.
Bloque s. Comprende los dos primeros grupos, es decir, metales alcalinos y alcalinotérreos, además del hidrógeno y el helio.