45 Ejemplos de
Calor específico, sensible y latente
El calor específico, el calor sensible y el calor latente son magnitudes físicas:
![]()
![]() Calor específico. Es la cantidad de calor que hay que suministrar a una unidad de masa de una sustancia para elevar su temperatura en una unidad. Esa cantidad varía dependiendo de la temperatura en que se encuentra la sustancia antes de aplicarle el calor. Por ejemplo, es necesaria una caloría (cal) para aumentar en un grado Celsius la temperatura de 1 gramo de agua que inicialmente estaba a temperatura ambiente, pero son necesarias solo 0,5 calorías para aumentar en un grado Celsius la temperatura del hielo que estaba inicialmente a -5 ºC.
Calor específico. Es la cantidad de calor que hay que suministrar a una unidad de masa de una sustancia para elevar su temperatura en una unidad. Esa cantidad varía dependiendo de la temperatura en que se encuentra la sustancia antes de aplicarle el calor. Por ejemplo, es necesaria una caloría (cal) para aumentar en un grado Celsius la temperatura de 1 gramo de agua que inicialmente estaba a temperatura ambiente, pero son necesarias solo 0,5 calorías para aumentar en un grado Celsius la temperatura del hielo que estaba inicialmente a -5 ºC.
El calor específico también depende de la presión atmosférica. La misma sustancia a una presión menor tiene un mayor calor específico, esto es considerando que el volumen del recipiente donde está contenida la sustancia es constante. Los ejemplos que aparecen a continuación son válidos para una temperatura de 25 ºC y a una presión de 1 atmósfera.![]()
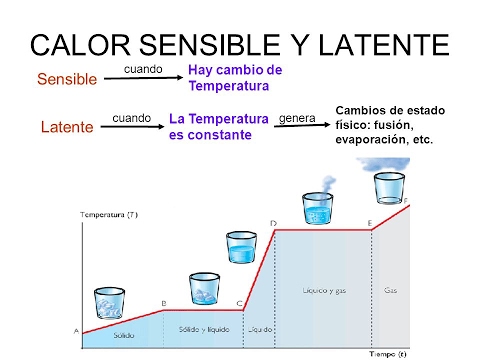
![]() Calor sensible. Es la cantidad de calor que puede recibir un cuerpo sin que se afecte su estructura molecular. Si no cambia la estructura molecular, no cambia el estado de agregación (sólido, líquido, gaseoso). Dado que no cambia la estructura molecular, se observa un cambio de temperatura. Por eso, se denomina calor sensible.
Calor sensible. Es la cantidad de calor que puede recibir un cuerpo sin que se afecte su estructura molecular. Si no cambia la estructura molecular, no cambia el estado de agregación (sólido, líquido, gaseoso). Dado que no cambia la estructura molecular, se observa un cambio de temperatura. Por eso, se denomina calor sensible.![]()
![]() Calor latente. Es la energía (en forma de calor) necesaria para que una sustancia cambie de fase (estado de agregación). Si el cambio es de sólido a líquido, se denomina calor de fusión. Si el cambio es de líquido a gaseoso, se denomina calor de vaporización. Cuando se le aplica calor a una sustancia que ha llegado a la temperatura en que cambia de estado, es imposible que aumente la temperatura durante el cambio de fase. Cuando alcanza esa temperatura (que varía dependiendo de cada sustancia), simplemente cambia de estado. En este caso, el calor es empleado en cambiar de fase y no en aumentar la temperatura de la sustancia. Por ejemplo, si se continúa aplicando calor al agua en ebullición, no sobrepasará nunca los 100 °C. Dependiendo de la sustancia, el calor latente puede medirse habitualmente en calorías por gramo (cal/g) o en kilojoules por kilogramo (kJ/kg).
Calor latente. Es la energía (en forma de calor) necesaria para que una sustancia cambie de fase (estado de agregación). Si el cambio es de sólido a líquido, se denomina calor de fusión. Si el cambio es de líquido a gaseoso, se denomina calor de vaporización. Cuando se le aplica calor a una sustancia que ha llegado a la temperatura en que cambia de estado, es imposible que aumente la temperatura durante el cambio de fase. Cuando alcanza esa temperatura (que varía dependiendo de cada sustancia), simplemente cambia de estado. En este caso, el calor es empleado en cambiar de fase y no en aumentar la temperatura de la sustancia. Por ejemplo, si se continúa aplicando calor al agua en ebullición, no sobrepasará nunca los 100 °C. Dependiendo de la sustancia, el calor latente puede medirse habitualmente en calorías por gramo (cal/g) o en kilojoules por kilogramo (kJ/kg).
![]()
![]() Puede servirte: Conducción, convección y radiación
Puede servirte: Conducción, convección y radiación
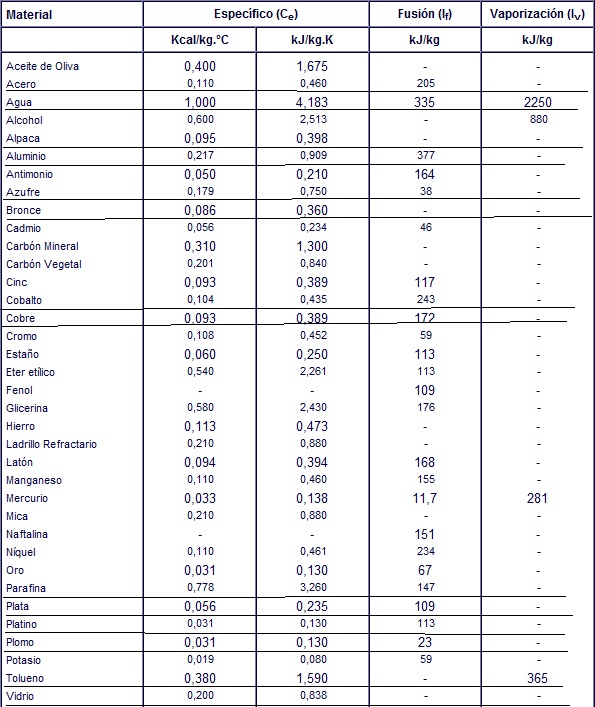
Ejemplos de calor específico
- Agua (en estado líquido): 1 caloría por gramo para aumentar 1 °C.
- Aluminio: 0.215 caloría por gramo y por grados Celsius (cal/g°C )
- Berilio: 0.436 cal/g°C
- Cadmio: 0.055 cal/g°C
- 0.0924 cal/g°C
- Glicerina: 0.58 cal/g°C
- Oro: 0.0308 cal/g°C
- Hierro: 0.107 cal/g°C
- Plomo: 0.0305 cal/g°C
- Silicio: 0.168 cal/g°C
- Plata: 0.056 cal/g°C
- Potasio: 0.18 cal/g°C
- Tolueno: 0.2 cal/g°C
- Vidrio: 0.17 cal/g°C
- Mármol: 0.21 cal/g°C
- Madera: 0.41 cal/g°C
- Alcohol etílico: 0.58 cal/g°C
- Mercurio: 0.033 cal/g°C
- Aceite de oliva: 0.47 cal/g°C
- Arena: 0.2 cal/g°C

Ejemplos de calor sensible
- Aplicar calor al agua hasta que su temperatura esté entre 1 y 100 °C.
- Aplicar calor al estaño hasta que su temperatura esté a menos de 240 °C.
- Aplicar calor al plomo hasta que su temperatura esté a menos de 327 °C.
- Aplicar calor al zinc hasta que su temperatura esté a menos de 420 °C.
- Aplicar calor al aluminio hasta que su temperatura esté a menos de 660 °C.
- Aplicar calor al bronce hasta que su temperatura esté a menos de 880 °C.
- Aplicar calor al níquel hasta que su temperatura se encuentre a menos de 1450 °C.

Ejemplos de calor latente
- Agua. Calor latente de fusión: 80 calorías por gramo (cal/g) (son necesarias 80 calorías para que un gramo de hielo a 0 °C se convierta en agua), calor latente de vaporización: 540 calorías por gramo (son necesarias 540 calorías para que un gramo de agua a 100 °C se convierta en vapor).
- Acero. Calor latente de fusión: 25 kJ/kg.
- Aluminio. Calor latente de fusión: 322-394 x103 J/kg; calor latente de vaporización: 9220 x103 J/kg.
- Azufre. Calor latente de fusión: 38 kJ/kg; calor latente de vaporización: 326 kJ/kg.
- Cobalto. Calor latente de fusión: 263 J/g.
- Cobre. Calor latente de fusión: 214 x103 J/kg; calor latente de vaporización: 5410 x103 J/kg.
- Estaño. Calor latente de fusión: 59 x103 J/kg.
- Fenol. Calor latente de fusión: 122.6 kJ/mol.
- Hierro. Calor latente de fusión: 293 x103 J/kg; calor latente de vaporización: 6300 x103 J/kg.
- Magnesio. Calor latente de fusión: 362 J/g.
- Mercurio. Calor latente de fusión: 11.73 x103 J/kg ; calor latente de vaporización: 285 x103 J/kg.
- Níquel. Calor latente de fusión: 292 J/g.
- Plata. Calor latente de fusión: 88.3 kJ/kg.
- Plomo. Calor latente de fusión: 22.5 x103 J/kg; calor latente de vaporización: 880 x103 J/kg.
- Oxígeno. Calor latente de fusión: 13.8 kJ/kg.
- Oro. Calor latente de fusión: 64.5 kJ/kg.
- Zinc. Calor latente de fusión: 111 J/g.
Sigue con:
 Compartir en Facebook
Compartir en Facebook Twittear
Twittear
 Calor específico. Es la cantidad de
Calor específico. Es la cantidad de  Puede servirte:
Puede servirte: