Definición de unión covalente
Antes de entrar de lleno en la definición de unión covalente, es necesario que procedamos a conocer el origen etimológico de las dos palabras que le dan forma:
-Unión es un término que deriva del latín, concretamente de “unus”, que puede traducirse como “uno”.
-Covalente, por otro lado, también procede del citado latín. En su caso, es fruto de la suma de tres componentes del mismo: el prefijo “con-”, que es equivalente a “junto”; el verbo “valere”, que puede traducirse como “valer”; y el sufijo “-nte”, que se utiliza para indicar al agente.
Una unión es un vínculo entre dos o más elementos. Covalente, por su parte, es un concepto que se emplea en el terreno de la química para referirse al enlace que forman los átomos cuando comparten pares de electrones.
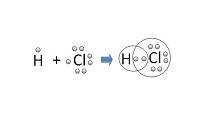 El concepto de unión covalente, por lo tanto, refiere a un tipo de nexo que establecen los átomos. Es importante tener en cuenta que los átomos están compuestos por electrones, neutrones y protones. Los electrones, que disponen de carga negativa, orbitan en torno al núcleo atómico.
El concepto de unión covalente, por lo tanto, refiere a un tipo de nexo que establecen los átomos. Es importante tener en cuenta que los átomos están compuestos por electrones, neutrones y protones. Los electrones, que disponen de carga negativa, orbitan en torno al núcleo atómico.
Muchos son los ejemplos a los que se recurren para poder explicar qué es una unión o enlace covalente y dónde se puede encontrar. Así, por ejemplo, entre los más habituales está el que apuesta por hacer protagonista al gas cloro. Y es que este se encuentra conformado por moléculas Cl2 en las que los dos átomos de cloro se hallan unidas mediante el citado enlace covalente.
Se llama enlace químico a la fuerza que logra que los átomos permanezcan unidos. Existen diferentes clases de enlaces o uniones: la unión covalente es aquella que surge cuando los átomos comparten electrones de a pares.
Al unirse, los átomos pueden compartir, aceptar o ceder electrones. Aquellos que electrones que se sitúan en la última capa atómica, denominados electrones de valencia, son los que pueden compartirse.
De acuerdo a la regla del octeto, los átomos tienden a completarse con ocho electrones de valencia para alcanzar la estabilidad. Para acceder a este número es que los átomos ceden, aceptan o, en el caso de la unión covalente, comparten átomos.
Los átomos no metálicos son los protagonistas de las uniones covalentes. Los electrones de valencia, en este caso, son compartidos por dos átomos: es decir, forman parte de más de un átomo. El enlace puede ser triple, doble o simple según el caso.
La unión covalente, de este modo, se diferencia de la unión iónica, donde los electrones son transferidos de un átomo a otro.
En lo que respecta a los llamados enlaces covalentes hay que subrayar que existe una base fundamental que se hace necesario conocer al respecto. Nos estamos refiriendo a la llamada Teoría o Estructura de Lewis, que viene a establecer los siguientes principios o máximas del mencionado enlace:
-Se elige el átomo central que, por regla general, suele ser el menos electronegativo.
-Se cuentan los electrones de Valencia.
-Se forman los enlaces entre el átomo central y los periféricos.
-Los electrones restantes se proceden a colocar como pares solitarios para completar lo que son los citados octetes.
