Pentanona: estructura química, propiedades, síntesis, usos
La pentanona es un compuesto orgánico, perteneciente a la familia de las cetonas, cuya fórmula química es C5H10O. Sigue siendo una de las cetonas más simples, y consiste de un líquido incoloro con un aroma parecido al de la acetona. A partir de ella en adelante, respecto al número de carbono de su esqueleto, las cetonas presentan isomería de posición.
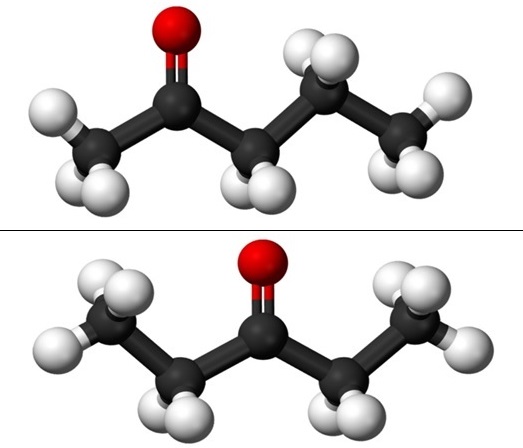
Cuando se habla de isomería de posición se refiere a dónde está el grupo carbonilo, C=O. Así pues, la pentanona en realidad consiste de dos compuestos con propiedades físicas que difieren apenas entre sí: 2-pentanona y 3-pentanona (imagen inferior). Ambas son líquidas, pero sus puntos de ebullición son los mismos, por lo que no pueden ser separadas por destilación.
No obstante, cada una de las dos pentanonas posee su propia ruta de síntesis, por lo que es poco probable que haya una mezcla de las mismas; mezcla que quizás sea factible de separar mediante congelamiento.
Sus usos se restringen especialmente como solventes orgánicos; alternativas a la acetona en medios donde se trabaje con una temperatura superior a su bajo punto de ebullición. Asimismo, son materiales de partida para otras síntesis orgánicas, pues su grupo C=O puede reducirse o sufrir adición nucleofílica.
Índice del artículo
En la imagen tenemos las estructuras moleculares de los dos isómeros de posición para la pentanona, representados por un modelo de esferas y barras. Las esferas negras corresponden a los esqueletos carbonados, las blancas a los átomos de hidrógeno, y las rojas a los átomos de oxígeno del grupo C=O.
2-pentanona
La 2-pentanona (arriba) tiene el grupo C=O en el segundo carbono, el cual es equivalente a que si estuviera en el cuarto; es decir, la 2-pentanona y la 4-pentanona son equivalentes, pues basta con rotarlas 180º para que sus estructuras sean las mismas.
A la izquierda del C=O se tiene un radical metil, CH3-, y a su derecha, un radical propil. Es por eso que esta cetona también recibe el nombre (menos utilizado) de metil propil cetona (MPK en inglés). Se puede observar la asimetría de esta estructura a primera vista.
3-pentanona
La 3-pentanona (abajo) tiene el grupo C=O en el tercer carbono. Nótese que este isómero es una versión más grande de la acetona, y que es además muy simétrico; los dos radicales a los lados del grupo C=O son los mismos: dos radicales etílicos, CH3CH2-. Es por eso que la 3-pentanona también se llama dietil cetona (o dimetil acetona).
La presencia del grupo carbonilo, tanto en la 2-pentanona como en la 3-pentanona, confiere polaridad a la molécula.
Por lo tanto, ambos isómeros de la pentanona son capaces de interaccionar entre sí mediante fuerzas dipolo-dipolo, en las cuales la mayor densidad de carga negativa, δ-, vista en un mapa de potencial electrostático, se orientará alrededor del átomo de oxígeno.
Asimismo, intervienen en menor grado las fuerzas de dispersión de London entre los esqueletos carbonados e hidrogenados.
Al tener la pentanona un área y masa moleculares mayores en comparación a los de la acetona, este aporte se suma a su momento dipolar y permite que posea un punto de ebullición más alto (102 ºC > 56 ºC). De hecho, los dos isómeros se vaporizan a 102 ºC; mientras que se congelan a distintas temperaturas.
Probablemente en la cristalización sí jueguen un papel importante las simetrías. Por ejemplo, el punto de fusión de la 2-pentanona es -78 ºC, mientras que el de la 3-pentanona, -39 ºC.
Esto significa que los cristales de la 3-pentanona son más estables frente a la temperatura; sus moléculas se hallan más cohesionadas y requieren de más calor para que se separen en la fase líquida.
Si hubiera una mezcla de ambos isómeros, la 3-pentanona sería la primera en cristalizar, siendo por último la 2-pentanona a una temperatura menor. Las moléculas de la 3-pentanona, más simétrica, se orientan con mayor facilidad que las de 2-pentanona: asimétricas y a la vez más dinámicas.
Líquidos incoloros con un aroma similar al de la acetona.
86,13 g/mol
0,81 g/mL (3-pentanona)
0,809 g/mL (2-pentanona)
-78 ºC (2-pentanona)
-39 ºC (3-pentanona)
102 ºC (para ambos isómeros)
35 g/L (3-pentanona)
60 g/L (2-pentanona)
35 mmHg (3-pentanona)
270 mmHg (2-pentanona) a 20 ºC
Estos valores no son útiles para comparar directamente las presiones de vapor de ambos isómeros, pues el primero viene reportado sin la temperatura a la que se midió.
12,78 ºC (3-pentanona)
10 ºC (2-pentanona)
Los dos isómeros de la pentanona son extremadamente inflamables, por lo que deben permanecer lo más alejados posible de cualquier fuente de calor. Los puntos de destello indican que una llama puede incendiar los vapores de ambas pentanonas inclusive a una temperatura de 10 ºC.
Aunque los dos isómeros de la pentanona sean física y químicamente muy similares, sus rutas sintéticas son independientes una de la otra, por lo que es improbable que se obtengan ambas en una misma síntesis.
Partiendo del reactivo 2-pentanol, un alcohol secundario, este puede oxidarse al 2-pentanona empleando ácido hipocloroso formado in situ, HClO, como agente oxidante. La oxidación vendría a ser:
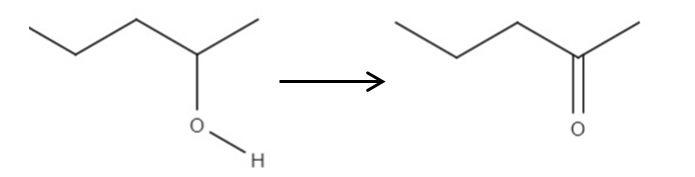
Simplemente el enlace C-OH pasa a ser C=O. Hay otros métodos para sintetizar la 2-pentanona, pero de todos este es el más sencillo de comprender.
La 3-pentanona puede sintetizarse mediante la descarboxilación cetónica del ácido propanoico, CH3CH2COOH. Esta ruta sintética produce cetonas simétricas, y consiste en que una molécula de CH3COOH perderá el grupo COOH en forma de CO2, mientras la otra su grupo OH en forma de H2O:
2CH3CH2COOH => CH3CH2COCH2CH3 + CO2 + H2O
Otra ruta un poco más compleja consiste en hacer reaccionar directamente una mezcla de etileno, CH2=CH2, CO2 y H2 para formar la 3-pentanona.
A menos que la aplicación sea muy rigurosa, se trate de una síntesis específica, o que se haya demostrado además que los dos isómeros no originan iguales resultados, es irrelevante escoger entre emplear la 2-pentanona o 3-pentanona en cualquiera de sus usos.
Es decir, “no importa” si se quiere utilizar la 2-pentanona o 3-pentanona como solvente de pinturas o resinas, o como un desgrasante, pues el criterio más importante vendrá a ser su precio y disponibilidad. La 3-pentanona se utiliza en la industria automotriz para estudiar el comportamiento de los gases dentro de los motores de combustión interna.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Wikipedia. (2019). 3-Pentanone. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). 2-Pentanone. PubChem Database. CID=7895. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2019). 3-Pentanone. Recuperado de: chemspider.com
- Professor T. Nalli. (2013). Oxidation of 2-Pentanol and Distillation of the Product. Recuperado de: course1.winona.edu
