Receptores de insulina: características, estructura, funciones
Los receptores de insulina son unas estructuras proteicas expuestas en el lado extracelular de la membrana plasmática de muchas células del cuerpo humano y del de otros mamíferos. El ligando natural de este receptor es la insulina.
La insulina es una hormona sintetizada por las células ß de los islotes de Langerhans de la porción endocrina del páncreas, un órgano situado en la cavidad abdominal que sintetiza enzimas digestivas y hormonas.
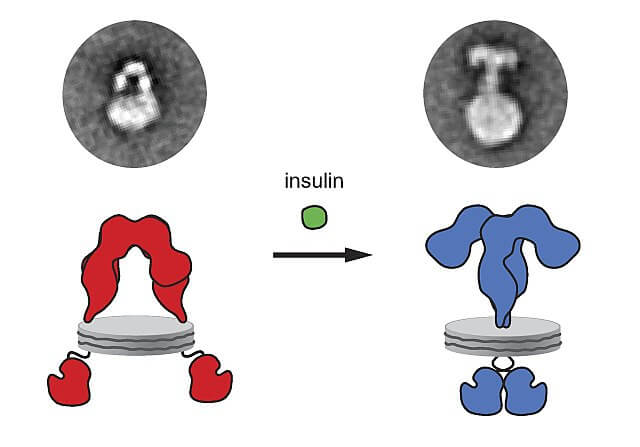
La insulina sintetizada y liberada por el páncreas se une a su receptor en la membrana plasmática de las células blanco y como consecuencia de esta unión ligando-receptor se desencadenan una serie de procesos intracelulares que finalmente promueven el ingreso de glucosa a dichas células.
La insulina es responsable de la activación de muchas reacciones anabólicas o de síntesis relacionadas con el metabolismo de carbohidratos, grasas y proteínas.
Los receptores de insulina son unas glucoproteínas formadas por cuatro subunidades con su porción amino y carboxilo terminal en la región citoplasmática. Cuando estos receptores se unen a la insulina se agrupan y endocitan.
En la obesidad y en la diabetes tipo II, el número de receptores de insulina está disminuido y esto explica en parte la resistencia a la insulina que acompaña a estas condiciones patológicas.
Índice del artículo
Los receptores de insulina forman parte de una familia de receptores membranales que tienen sitios de unión para hormonas de naturaleza proteica. Este tipo de hormonas no pueden atravesar las membranas celulares por lo que sus efectos metabólicos se ejecutan por mediación de sus receptores.
La insulina es una hormona peptídica relacionada con la promoción de reacciones de síntesis llamadas en conjunto reacciones anabólicas, que se relacionan con el metabolismo de los carbohidratos, las grasas y las proteínas.
Muchas células poseen receptores de insulina, principalmente las células musculares, las del hígado y las del tejido adiposo. Sin embargo, otras células que aparentemente no son células dianas de la insulina también poseen receptores de insulina.
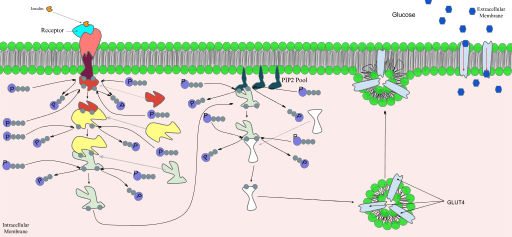
El ingreso de glucosa a las células, en algunos tejidos, es dependiente de la insulina ya que, en ellas, las proteínas responsables de la difusión facilitada de la glucosa se encuentran en pequeños trozos de membrana formando vesículas intracelulares.
Cuando la insulina se une a su receptor en este tipo de células insulino-dependientes, los transportadores de glucosa ubicados en las vesículas intracelulares se mueven y se presentan en la superficie de la membrana celular al fusionarse dichas vesículas con esta membrana.
El musculo esquelético y las células del tejido adiposo son, entre otros, un ejemplo de este mecanismo.
Los receptores de insulina tienen una vida media relativamente corta de unas 7 a 12 horas, por lo que constantemente se sintetizan y degradan. En los mamíferos, la concentración de receptores es de aproximadamente 20.000 receptores por célula.
Cuando la insulina se une al receptor se produce un cambio conformacional del receptor, los receptores vecinos se mueven, se producen micro-agregados y luego se interioriza el receptor. Al mismo tiempo se generan las señales que luego amplificaran las respuestas.

El gen que codifica para el receptor de insulina se encuentra en el cromosoma 19 y posee 22 exones. Este receptor está formado por cuatro subunidades de glucoproteínas unidas por puentes disulfuro.
Se sintetiza en el retículo endoplásmico inicialmente como una cadena polipeptídica sencilla de unos 1382 aminoácidos que luego es fosforilada y escindida para formar las subunidades α y ß.
Las cuatro subunidades del receptor de insulina son dos alfas (α) con un peso molecular de 140.000 Da y dos betas (β) más pequeñas, con un peso molecular aproximado de 95.000 Da.
Las subunidades α son extracelulares y están expuestas en la superficie externa de la membrana celular. Las subunidades β, por otro lado, atraviesan la membrana y se exponen o sobresalen en la superficie interna de la misma (mirando hacia el citoplasma).
En las subunidades α se encuentra el sitio de unión para la insulina. En las unidades β hay un sitio de unión para el ATP que activa la función de quinasa de esta subunidad e induce la autofosforilación del receptor en los residuos de tirosina de la subunidad β.
Estos receptores forman parte de una familia de receptores asociados a enzimas citoplasmáticas como la tirosina-quinasa, enzima que se activa cuando la insulina se une al receptor e inicia un proceso de fosforilación y desfosforilación de una serie de enzimas que serán las responsables de los efectos metabólicos de la insulina.
La subunidad α de los receptores de insulina tiene el sitio de unión para la insulina. Cuando esta unidad se une a su ligando ocurren cambios conformacionales en la estructura del receptor que activan a las subunidades β que son las responsables de los mecanismos de transducción de la señal y, por ende, de los efectos de la insulina.
En los dominios citoplasmáticos del receptor se activa una tirosina-quinasa que inicia la transmisión de las señales por medio de una cascada de quinasas. Lo primero que ocurre es la fosforilación o autofosforilación del receptor de insulina y seguidamente se fosforilan los llamados sustratos del receptor de insulina o IRS.
Se han descrito cuatro sustratos del receptor de insulina denominados IRS-1, IRS-2, IRS-3 y IRS-4. La fosforilación de estos ocurre en unos residuos de tirosina, serina y de treonina. Cada uno de estos sustratos está relacionado con diferentes cascadas de quinasas involucradas en los efectos metabólicos de la insulina.
Por ejemplo:
- Los IRS-1 parecen estar relacionados con el efecto de la insulina en el crecimiento celular.
- Los IRS -2 se relacionan con los efectos metabólicos de la hormona, como son el aumento de la síntesis de glucógeno, de lípidos y de proteínas, y con la translocación de proteínas como las proteínas del receptor y las del transporte de glucosa.
La diabetes es una enfermedad que afecta un porcentaje muy alto de la población mundial y está relacionada con defectos en la producción de insulina, pero también con una función deficiente de los receptores de insulina.
Existen dos tipos de diabetes: la diabetes tipo I o diabetes juvenil, que es insulino-dependiente, y la diabetes tipo II o diabetes del adulto, que no es insulino-dependiente.
La diabetes tipo I se debe a una producción insuficiente de insulina y se acompaña de hiperglicemia y cetoacidosis. La diabetes tipo II se relaciona con factores genéticos que afectan tanto la producción de insulina como la función de sus receptores y se acompaña de hiperglicemia sin cetoacidosis.
- American Diabetes Association. (2010). Diagnosis and classification of diabetes mellitus. Diabetes care, 33(Supplement 1), S62-S69.
- Berne, R., & Levy, M. (1990). Physiology. Mosby; International Ed edition.
- Fox, S. I. (2006). Human Physiology (9th ed.). New York, USA: McGraw-Hill Press.
- Guyton, A., & Hall, J. (2006). Textbook of Medical Physiology (11th ed.). Elsevier Inc.
- Lee, J., & Pilch, P. F. (1994). The insulin receptor: structure, function, and signaling. American Journal of Physiology-Cell Physiology, 266(2), C319-C334.
