Electrodiálisis: cómo funciona, ventajas, desventajas, usos
La electrodiálisis es el movimiento de iones a través de una membrana semipermeable, impulsado por una diferencia de potencial eléctrico. Las membranas utilizadas en la electrodiálisis tienen la propiedad de ser intercambiadores iónicos para los cationes o para los aniones.
Las membranas de intercambio catiónico tienen cargas negativas: dejan pasar los cationes y repelen a los aniones. Mientras, las membranas de intercambio aniónico tienen carga positiva: dejan pasar a los aniones y repelen a los cationes.
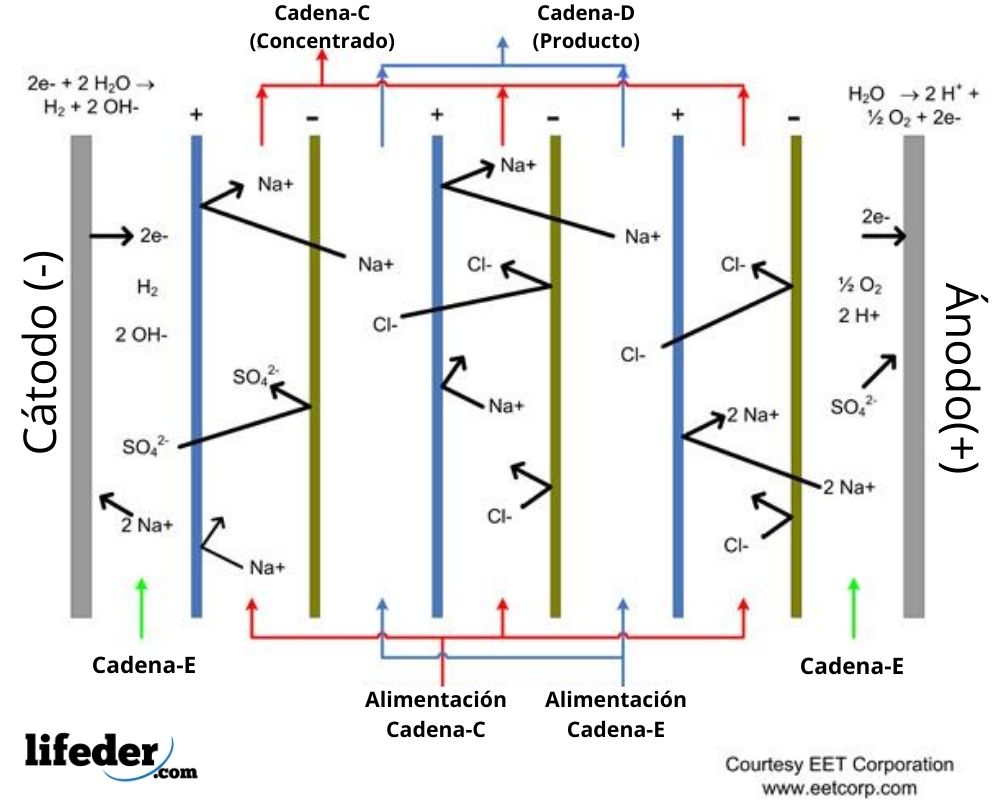
Las cámaras o celdas de electrodiálisis se organizan en paquetes con varias membranas de intercambio aniónico y catiónico, las cuales se alternan entre sí. Las membranas de intercambio aniónico y catiónico delimitan los espacios donde se realizan los procesos de dilución y concentración de los líquidos.
La fuerza impulsora de los flujos iónicos que atraviesan las membranas de las celdas de electrodiálisis es una diferencia de potencial eléctrico existente entre un cátodo y un ánodo.
Mientras, en la ósmosis reversa el flujo de agua desde el compartimiento con mayor osmolaridad hacia el compartimiento de menor osmolaridad es debido a un incremento de la presión hidrostática, causada por la acción de una bomba.
Índice del artículo
- 1 ¿Cómo funciona en la dilución del agua?
- 2 Ventajas y desventajas
- 3 Diferencia entre diálisis y electrodiálisis
- 4 Aplicaciones de la electrodiálisis
- 5 Referencias
En el esquema mostrado (imagen superior) se señalan la ubicación de seis membranas de intercambio iónico: tres de intercambio catiónico y tres de intercambio aniónico, las cuales se intercalan entre sí. Estas membranas delimitan cinco compartimientos donde circulan los líquidos que intervienen en la electrodiálisis (ver flechas rojas y azuladas).
Las membranas de intercambio aniónico están cargadas positivamente, apareciendo en el esquema mostrado de color azul. Estas dejan pasar los aniones y repelen a los cationes por repulsión electrostática.
Las membranas de intercambio catiónico, mientras, tienen carga negativa, señalándose en el esquema de color verde. Son atravesadas por los cationes, repeliendo sin embargo a los aniones.
Ambos tipos de membranas son impermeables al agua. El esquema muestra dos espacios donde se produce una dilución del contenido salino del agua. En el esquema aparecen señalados en azul los flujos acuosos de ingreso y salida de estos espacios, identificados como corriente D.
Mientras, existen tres espacios donde circula el agua con un alto contenido salino, estando identificados de color rojo. Los flujos de ingreso y salida a estos compartimientos se señalan en el esquema como corriente C.
Asimismo, aparecen señalados en el esquema los compartimientos del ánodo (+) y del cátodo (-), por los cuales circula la corriente E.
Los cationes son atraídos por la carga del cátodo (-), mientras los repele el ánodo (+). Los aniones son atraídos por la carga del ánodo (+) y repelidos por la carga del cátodo (-).
La observación, por ejemplo, de las celdas tres, cuatro y cinco, indica lo siguiente: en las celdas tres y cinco circula líquido concentrado, mientras que en la celda cuatro circula líquido de dilución.
El ión Cl– del compartimiento cuatro se siente atraído por la carga del ánodo y atraviesa la membrana de intercambio aniónico que lo separa del compartimiento cinco.
Mientras tanto, el ion Na+ del compartimiento cinco es repelido por la carga positiva del ánodo, pero sin poder ingresar al compartimiento cuatro. Esto se debe a que la membrana que separa los compartimientos cuatro y cinco es de intercambio aniónico, por lo que repele a los cationes.
Por otro lado, el Na+ del compartimiento cuatro es repelido por el ánodo (+) y atraviesa la membrana de intercambio catiónico (-) que lo separa del compartimiento tres.
En resumen: la concentración de Na+ y Cl– del compartimiento cuatro tiende a disminuir. Entonces, la concentración salina disminuye en los compartimientos de dilución y aumenta en los compartimientos de concentración.
-La electrodiálisis es de operación simple y continua.
-No se requiere de tratamiento químico para regenerar las membranas de intercambio.
-Hay un bajo costo de operación y mantenimiento, requiriendo poco espacio para su funcionamiento.
-Las partículas con un diámetro mayor a 1 µm, pueden obstruir las membranas de intercambio iónico.
-No es recomendable el uso de agua con una dureza mayor a 1, ya que el carbonato de calcio crea una costra en las celdas de concentrado.
-Requiere tratamiento de eliminación del dióxido de carbono (CO2), ya que este al disociarse puede modificar la conductividad del agua.
La diálisis es el flujo de agua a través de una membrana semipermeable del compartimiento de menor osmolaridad al compartimiento de mayor osmolaridad. El compartimiento con menor osmolaridad tiene mayor concentración de moléculas de agua.
Por esta razón el agua fluye, en favor de su gradiente de concentración, del compartimiento con menor osmolaridad al compartimiento con mayor osmolaridad.
La electrodiálisis, en cambio, es un flujo de iones a través de una membrana de intercambio iónico que deja pasar o no a los iones, dependiendo de su carga eléctrica. La fuerza impulsora del movimiento de los iones es una diferencia de potencial eléctrico.
A diferencia de la diálisis, en la electrodiálisis no hay flujo de agua a través de las membranas y solamente existe el flujo de iones.
Existen plantas de electrodiálisis que procesan agua con alto contenido de sales para producir agua potable. También es utilizada la electrodiálisis para procesar las aguas residuales provenientes del uso doméstico e industrial, con el propósito de hacerlas aptas para su consumo posterior.
Específicamente se utiliza la electrodiálisis en la recuperación de metales valiosos presentes en las aguas efluentes de las industrias. Asimismo se usa en la remoción de las sales y los ácidos de soluciones acuosas, y en la separación de compuestos iónicos de moléculas neutras.
Aunque se utiliza la electrodiálisis en la industria farmacéutica, en la de cosméticos, así como en otras industrias, su uso más generalizado es en la industria de los alimentos. Entre alguna de sus aplicaciones podemos mencionar las siguientes:
-Desmineralización del suero y la melaza
-Estabilización del ácido tartárico del vino
-Disminución de la acidez de los zumos de frutas
-Producción de aislados de proteínas vegetales
-Fraccionamiento de las proteínas del suero
-Desmineralización de los aceites de soya y pescado
-Eliminación de iones alcalinos de la remolacha y la melaza de caña
-Tratamiento de desechos de mariscos
-Desmineralización de mosto de uva y del jugo de papa
-Concentración y recuperación de ácidos orgánicos
-Producción de proteínas de soya
-Enriquecimiento de antioxidantes
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2020). Electrodialysis. Recuperado de: en.wikipedia.org
- Lenntech B.V. (2020). What is EDI? Recuperado de: lenntech.com
- Mondor M., Ippersiel D., Lamarche F. (2012) Electrodialysis in food processing. In: Boye J., Arcand Y. (eds) Green Technologies in Food Production and Processing. Food Engineering Series. Springer, Boston, MA. doi.org/10.1007/978-1-4614-1587-9_12
- Akhter M, Habib G, Qamar SU (2018) Application of Electrodialysis in Waste Water Treatment and Impact of Fouling on Process Performance. J Membr Sci Technol 8: 182. doi: 10.4172/2155-9589.1000182
- H. Strathmann. (06 de diciembre de 2006). Electrodialysis and Its Application in the Chemical Process Industry. Taylor & Francis Online. doi.org/10.1080/03602548508068411
