Ácido nitroso (HNO2): estructura, propiedades, síntesis
El ácido nitroso es un ácido débil, inorgánico, cuya fórmula química es HNO2. Se encuentra fundamentalmente en solución acuosa con una coloración azul pálido. Es muy inestable, y rápidamente se descompone en óxido nítrico, NO, y en ácido nítrico, HNO3.
Suele encontrarse en solución acuosa bajo la forma de nitritos. Asimismo, proviene naturalmente de la atmósfera como consecuencia de la reacción del óxido nítrico con el agua. Allí, específicamente en la tropósfera, el ácido nitroso interviene en la regulación de la concentración de ozono.

En la imagen superior se muestra una solución de HNO2 en donde se aprecia el color azul pálido característico de este ácido. Se sintetiza por la disolución del trióxido de nitrógeno, N2O3, en agua. Igualmente, es producto de la acidificación de soluciones de nitrito sódico a bajas temperaturas.
El HNO2 tiene poco uso comercial, utilizándose bajo la forma de nitrito en la conservación de la carne. Por otro lado, se usa en la elaboración de los colorantes azoicos.
Se emplea, conjuntamente con el tiosulfato de sodio, en el tratamiento de pacientes con envenenamiento con cianuro de sodio. Pero, es un agente mutagénico, y se piensa que puede causar sustituciones en las bases de las cadenas del DNA, a través de una desaminación oxidativa de la citosina y la adenina.
El ácido nitroso tiene un comportamiento dual, ya que puede comportarse como un agente oxidativo o como un agente reductor; es decir, puede reducirse a NO o N2, u oxidarse a HNO3.
Índice del artículo
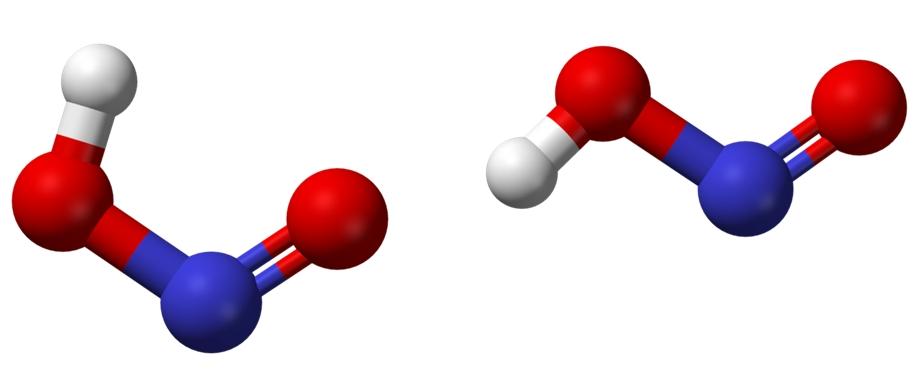
En la imagen superior se muestra la estructura molecular del ácido nitroso mediante un modelo de esferas y barras. El átomo de nitrógeno (esfera azul) se sitúa en el centro de la estructura, formando un enlace doble (N=O) y uno sencillo (N-O) con los átomos de oxígeno (esferas rojas).
Nótese que el átomo de hidrógeno (esfera blanca) está enlazado a uno de los oxígenos y no directamente al nitrógeno. Entonces, sabiendo esto, la fórmula estructural del HNO2 es [HO-N=O] o [NO(OH)], y no hay tal enlace H-N (como puede dar a pensar la fórmula química).
Las moléculas de la imagen corresponden a las de una fase gaseosa; en el agua se encuentran rodeadas de moléculas de agua, las cuales pueden aceptar el ion hidrógeno (débilmente) para formarse los iones NO2– y H3O+.
Sus estructuras pueden adoptar dos formas: la cis o la trans, llamadas isómeros geométricos. En el isómero cis, el átomo de H está eclipsado con el átomo de oxígeno vecino; mientras que en el isómero trans, ambos se encuentra en posiciones anti u opuestas.
En el isómero cis es probable la formación de un puente de hidrógeno intramolecular (OH—NO), el cual puede que importune los intermoleculares (ONOH—ONOH).
-Ácido Nitroso
-Ácido dioxonítrico (III)
-Hidróxido nitrosilo
-Hidróxidooxidonitrógeno (Nombre Sistemático IUPAC)
Líquido azul pálido, correspondiente a la solución de nitrito.
47,013 g/mol.
Es un ácido débil. Su pKa es 3,35 a 25 ºC.
Solamente es conocido en solución. Por lo tanto, no puede calcularse su punto de fusión, ni puede aislarse sus cristales.
Al no existir puro sino en el agua, las mediciones de esta propiedad no son precisas. Por un lado, depende de la concentración del HNO2, y por el otro, su calentamiento produce su descomposición. Es por eso que no se encuentra reportado un punto de ebullición exacto.
Forma nitritos solubles en agua con Li+, Na+, K+, Ca2+, Sr2+, Ba2+. Pero, no forma sales con cationes polivalentes, como por ejemplo: Al3+ y/o Be2+ (debido a su alta densidad de carga). Es capaz de formar esteres estables con los alcoholes.
Es inflamable por reacciones químicas. Puede explotar por contacto con tricloruro de fósforo.
Es un compuesto muy inestable, y en solución acuosa se descompone en óxido nítrico y en ácido nítrico:
2 HNO2 => NO2 + NO + H2O
4 HNO2 => 2 HNO3 + N2O + H2O
El ácido nitroso en solución acuosa se presenta bajo la forma de iones nitritos, NO2–, los cuales experimentan varias reacciones de reducción.
Reacciona con los iones I– y Fe2+, bajo la forma de nitrito de potasio, para formar óxido nítrico:
2 KNO2 + KI + H2SO4 => I2 + 2 NO + 2 H2O + K2SO2
El nitrito de potasio en presencia de los iones de estaño, es reducido para formar óxido nitroso:
KNO2 + 6 HCl + 2 SnCl2 => 2 SnCl4 + N2O + 3 H2O + 2 KCl
El nitrito de potasio es reducido por el Zn en un medio alcalino, formando amoníaco:
5 H2O + KNO2 + 3 Zn => NH3 + KOH + 3 Zn(OH)2
Además de ser un agente reductor, el ácido nitroso puede intervenir en procesos de oxidación. Por ejemplo: oxida al sulfuro de hidrógeno, convirtiéndose en óxido nítrico o amoníaco, dependiendo de la acidez del medio en el que ocurre la reacción.
2 HNO2 + H2S => S + 2 NO + 2 H2O
HNO2 + 3 H2S => S + NH3 + 2 H2O
El ácido nitroso, en un medio de pH ácido, puede oxidar el ión yoduro a yodo.
HNO2 + I– + 6 H+ => 3 I2 + NH3 + 2 H2O
También puede actuar como agente reductor actuando sobre el Cu2+, originando ácido nítrico.
Al HNO2 se le puede dar otros nombres, los cuales dependen del tipo de nomenclatura. Ácido nitroso corresponde a la nomenclatura tradicional; ácido dioxonítrico (III), a la nomenclatura stock; y dioxonitrato (III) de hidrógeno, a la sistemática.
El ácido nitroso puede ser sintetizado mediante la disolución del trióxido de nitrógeno en agua:
N2O3 + H2O => 2 HNO2
Otro método de preparación consiste de la reacción del nitrito sódico, NaNO3, con ácidos minerales; tales como el ácido clorhídrico y el ácido bromhídrico. La reacción es realizada a baja temperatura y el ácido nitroso es consumido in situ.
NaNO3 + H+ => HNO2 + Na+
El ion H+ proviene bien sea del HCl o HBr.
Dadas sus propiedades y características químicas, hay poca información acerca de los efectos tóxicos directos del HNO2. Quizás algunos efectos dañinos que se creen son producidos por este compuesto, son en realidad causados por el ácido nítrico, que puede producirse por descomposición del ácido nitroso.
Se señala que el HNO2 puede tener efectos dañinos sobre las vías respiratorias y ser capaz de producir síntomas de irritación en los pacientes asmáticos.
Bajo la forma de nitrito de sodio, es reducido por la desoxihemoglobina, produciendo óxido nítrico. Este es un potente vasodilatador que produce relajación de la musculatura lisa vascular, estimándose en los humanos una dosis LD50 de 35 mg/kg para el consumo oral.
La toxicidad del nitrito de sodio se manifiesta con un colapso cardiovascular, seguido de una hipotensión severa, debido a la acción vasodilatadora del óxido nítrico, producido a partir del nitrito.
El dióxido de nitrógeno, NO2, presente en el aire contaminado (smog), bajo determinadas condiciones puede originar el ácido nitroso; el cual a su vez, puede reaccionar con las aminas para formar nitrosaminas, una gamma de compuestos cancerígenos.
Una reacción semejante ocurre con el humo de los cigarrillos. Se ha hallado residuos de nitrosamina adheridos al revestimiento interior de vehículos de fumadores.
El ácido nitroso es utilizado en la industria en la producción de sales diazonio, mediante su reacción con las aminas aromáticas y fenoles.
HNO2 + ArNH2 + H+ => ArN=NAr + H2O
Las sales de diazonio son usadas en las reacciones de síntesis orgánica; por ejemplo, en la reacción de Sandmeyer. En esta reacción ocurre la sustitución de un grupo amino (H2N-), en una amina aromática primaria, por los grupos Cl–, Br– y CN–. Para la obtención de estos productos aromáticos se requiere de sales cuprosas.
Las sales de diazonio pueden formar compuestos azo brillantes que se usan como colorantes y también sirven como un test cualitativo para detectar la presencia de aminas aromáticas.
El ácido nitroso es usado para la eliminación de la azida de sodio (NaN3), la cual es potencialmente peligrosa por su tendencia a explotar.
2 NaN3 + 2 HNO2 => 3 N2 + 2 NO + 2 NaOH
El ácido nitroso puede reaccionar con grupos cetónicos para formar oximas. Éstas pueden ser oxidadas para formar ácido carboxilos o reducidas para originar aminas.
Este proceso es usado en la preparación comercial del ácido adípico, monómero usado en la producción del nailon. También interviene en la producción del poliuretano y sus esteres son plastificadores, principalmente en el PVC.
El ácido nitroso, bajo la forma de nitrito de sodio, se utiliza en el tratamiento y conservación de la carne; ya que, previene el crecimiento bacteriano y es capaz de reaccionar con la mioglobina, produciendo un color rojo oscuro que hace a la carne más atractiva para el consumo.
Se usa esta misma sal, conjuntamente con el tiosulfato de sodio, en el tratamiento intravenoso de un envenenamiento con cianuro de sodio.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- PubChem. (2019). Nitrous acid. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Softschools. (2019). Nitrous acid. Recuperado de: Softschools.com
- Wikipedia. (2019). Nitrous acid. Recuperado de: en.wikipedia.org
- Royal Society of Chemistry. (2015). Nitrous acid. Recuperado de: chemspider.com
- New World Encyclopedia. (2015). Nitrous acid. Recuperado de: newworldencyclopedia.org
- DrugBank. (2019). Nitrous acid. Recuperado de: drugbank.ca
- Formulación Química. (2018). HNO2. Recuperado de: formulacionquimica.com
