Agar TCBS: fundamento, preparación y uso
El agar TCBS es un medio de cultivo sólido altamente selectivo y diferencial, utilizado para el aislamiento y cultivo de bacterias del género Vibrio, especialmente Vibrio cholerae, V. vulnificus y V. parahaemolyticus como principales patógenos de este género.
Las siglas TCBS significan tiosulfato citrato bilis sacarosa. A este agar también se le conoce con el nombre de medio selectivo para Vibrios. La fórmula original fue creada por Nakanishi y posteriormente modificada por Kobayashi.

Está compuesto por extracto de levaduras, peptona de carne, tripteína, citrato de sodio, tiosulfato de sodio, bilis de buey, sacarosa, cloruro de sodio, citrato férrico, azul de bromotimol, azul de timol y agar.
Esta composición permite un adecuado desarrollo de las especies de Vibrio a partir de muestras de aguas, alimentos y heces; a excepción de Vibrio hollisae, que no crece en este medio. Además, el medio TCBS es capaz de inhibir el crecimiento de otras bacterias acompañantes, en especial coliformes.
Debido a los graves problemas gastrointestinales y extra-intestinales que producen algunas especies del género Vibrio, su diagnóstico es muy importante. El humano se infecta principalmente por el consumo de alimentos crudos o poco cocidos del mar o aguas contaminadas, pero también a través de la infección de heridas.
Debido a ello, los laboratorios clínicos deben incluir el agar TCBS en el estudio de coprocultivos de muestras de heces líquidas, especialmente con aspecto de agua de arroz. Especialmente si el paciente refiere haber estado en contacto con agua de mar o haber consumido mariscos o pescados.
Índice del artículo
El extracto de levaduras, las peptonas de carne, y la tripteína, son la fuente nutritiva de este medio. Sin embargo, el agar TCBS es un medio inhóspito para la mayoría de las bacterias.
Su alta selectividad viene dada por el agregado de citrato de sodio y bilis de buey; ambos son agentes inhibidores que además proporcionan un pH alcalino al medio, restringiendo el crecimiento de la flora acompañante y favoreciendo el crecimiento de V. cholerae, entre otras especies. Cabe destacar que Vibrio cholerae es muy sensible a la acidez.
Por su parte, el cloruro de sodio equilibra osmóticamente al medio. Además como su concentración es alta, también actúa como un agente inhibidor, favoreciendo el crecimiento de bacterias halófilas.
La sacarosa es el azúcar fermentable que junto a los indicadores de pH azul de bromotimol y azul de timol le dan el carácter diferencial al medio. Por tal motivo, con este medio es posible diferenciar las cepas fermentadoras de sacarosa de las no fermentadoras.
Las colonias de las cepas fermentadoras de sacarosa se desarrollan de color amarillo y harán virar el medio de verde a amarillo por la producción de ácidos. Las no fermentadoras crecen traslúcidas y el medio queda del color original (verde).
Así mismo, este medio contiene tiosulfato de sodio como fuente de azufre y citrato férrico como agente revelador. Ambos evidencian a las bacterias capaces de producir sulfuro de hidrógeno (gas incoloro). El H2S se forma a partir del tiosulfato y posteriormente al reaccionar con el citrato férrico se forma un precipitado negro visible.
Finalmente, el agar es el que proporciona la consistencia sólida al medio.
Pese 89 gr del medio deshidratado y disuelva en un litro de agua destilada. Ayude la disolución por calentamiento y agitación frecuente. La mezcla puede dejarse hervir hasta por 2 minutos.
Este medio no se autoclava. Después de su disolución se sirve directamente sobre placas estériles. Al solidificar se ordenan de forma invertida en plaqueros y se guardan en nevera (2-8°C) hasta su uso.
El medio después de preparado debe quedar a pH 8,6 ± 0,2.
El color del medio deshidratado es de color beige claro o beige-verdoso, y el color del medio es verde bosque o verde azulado.
Es importante dejar atemperar las placas antes de sembrar las muestras.
La muestra más común para el aislamiento de Vibrios son las heces diarreicas.
Las muestras de heces si no pueden ser sembradas inmediatamente en el medio selectivo, deben trasportarse en el medio de Cary Blair.
Para aumentar la sensibilidad del cultivo, las heces pueden ser pasadas por agua peptonada a pH 8,4 como medio de enriquecimiento durante 8 horas máximo, de allí se subcultiva al medio TCBS.
También hay que tener en cuenta que algunas cepas de Vibrios pueden causar septicemias en pacientes inmunosuprimidos, por tanto pueden aislarse de hemocultivos. Así mismo, pueden analizarse muestras de aguas y alimentos provenientes del mar, cuando existen brotes epidémicos de la enfermedad de cólera.
El inóculo de la muestra en estudio debe ser prominente, el sembrado se realiza por el método de estriamiento por agotamiento. Las placas se incuban a 37°C por 24 horas en aerobiosis.
Las colonias presuntivas de Vibrio cholerae son de tamaño mediano, lisas, opacas, de bordes delgados y de color amarillas debido a que fermentan la sacarosa.
De forma similar crecen las especies de V. alginolyticus, V. fluvialis, V. hareyi, V. cincinnatiensis, V. furnissii, V. metschnikovii y algunos V. vulnificus. Otras especies de Vibrios clínicamente importantes como V. parahaemolyticus no fermentan la sacarosa, desarrollándose como colonias verde oliva.
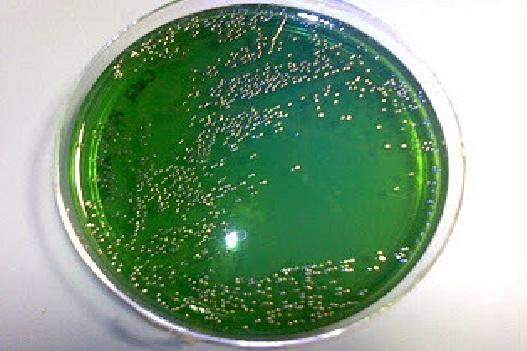
Por otra parte, hay que tener presente que algunas cepas de Aeromonas y Plesiomonas que son oxidasa (+) pueden crecer en este medio, desarrollando colonias amarillas que pueden confundir al clínico. Mientras que algunas cepas de Pseudomonas también oxidasa (+) crecen como colonias verdes al igual que V. parahaemolyticus.
La prueba de la oxidasa que es positiva para el género Vibrio jamás deberá realizarse a partir de colonias obtenidas del agar TCBS, pues el resultado obtenido será un falso negativo. Los compuestos del medio interfieren fuertemente en esta prueba. Por tanto, debe realizarse a partir de subcultivos en agar sangre.
Para probar que el medio está en buenas condiciones es recomendable sembrar cepas controles conocidas o certificadas, y observar si el crecimiento cumple con las características esperadas.
Para ello se pueden utilizar cepas de:
-Vibrio cholerae —– crecimiento satisfactorio (colonias amarillas, borde traslúcido).
-Vibrio parahaemolyticus ——– crecimiento satisfactorio (colonia con centro verde y borde traslúcida).
-Vibrio alginolyticus ATCC 17749 —— crecimiento satisfactorio (colonias amarillas con halos del mismo color alrededor de la colonia).
-Enterococcus faecalis ATCC 29212 —— inhibición total o parcial (colonias pequeñas amarillas o traslúcidas).
-Pseudomonas aeruginosa ATCC 27853—– inhibición parcial o total (colonias azules).
-Escherichia coli ATCC 25922 —— Inhibido completamente.
-Proteus mirabilis ATCC 43071 —– Inhibición total o parcial. (Pequeñas colonias centro verde borde traslúcido).
La incubación de un medio sin inocular no debe tener cambio.
- Laboratorios Difco Francisco Soria Melguizo. TCBS agar. 2009. Disponible en: f-soria.es
- Laboratorio BD. BD. TCBS Agar 2003. Disponible en: bd.com
- Laboratorios Britania. TCBS Medio. 2015. Disponible en: britanialab.com
- Laboratorios Acumedia. TCBS Agar. 2016. Disponible en: foodsafety.neogen.com
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. 5ta ed. Editorial Panamericana S.A. Argentina.
