Cicloalquinos: qué son, caracteristicas, aplicaciones, ejemplos
¿Qué son los cicloalquinos?
Los cicloalquinos son compuestos orgánicos, que presentan uno o más triples enlaces y una unidad cíclica. Sus fórmulas moleculares condensadas obedecen la fórmula CnH2n-4. Así, si n es igual a 3, entonces la fórmula de dicho cicloalquino será C3H2.
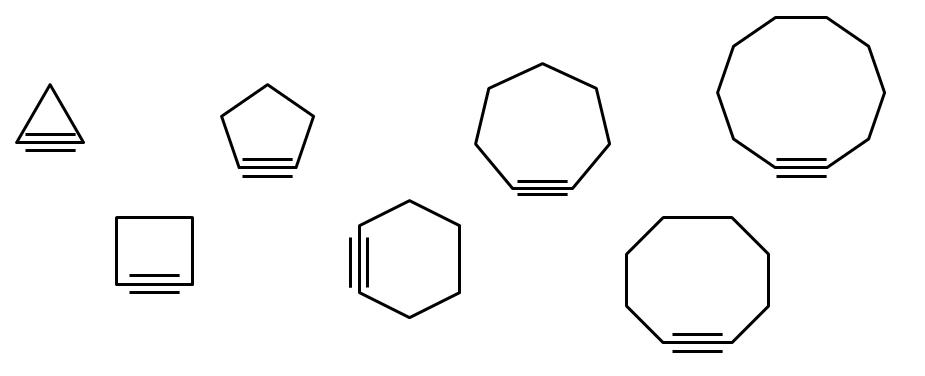
En la imagen superior se ilustra una serie de figuras geométricas, pero que en realidad consisten en ejemplos de cicloalquinos. Cada una de ellas puede considerarse como una versión más oxidada de los respectivos cicloalcanos (sin dobles o triples enlaces). Cuando carecen de un heteroátomo (O, N, S, F, etc.), son solamente “simples” hidrocarburos.
La química en torno a los cicloalquinos es muy compleja, y aún lo son más los mecanismos detrás de sus reacciones. Representan un punto de partida para la síntesis de muchos compuestos orgánicos, que a su vez están sujetos a posibles aplicaciones.
En términos generales, son muy reactivos a menos que se “distorsionen” o formen complejos con metales de transición. Asimismo, sus triples enlaces pueden conjugarse con dobles enlaces, creando unidades cíclicas dentro de las moléculas.
De no ser el caso, en sus estructuras más simples son capaces de adicionar a sus triples enlaces moléculas pequeñas.
Características de los cicloalquinos
Apolaridad y el triple enlace
Los cicloalquinos se caracterizan por ser moléculas apolares, y por consiguiente, hidrofóbicas. Esto puede cambiar si en sus estructuras poseen algún heteroátomo o grupo funcional que le confiera un momento dipolar considerable; como ocurre en los heterociclos con triples enlaces.
Pero, ¿qué es un triple enlace? No es más que tres interacciones simultáneas entre dos átomos de carbono con hibridación sp. Un enlace es simple (σ), y los otros dos π, perpendiculares entre sí. Ambos átomos de carbono tienen un orbital sp libre para enlazarse a otros átomos (R-C≡C-R).
Estos orbitales híbridos tienen un 50% de carácter s y un 50% de carácter p. Debido a que los orbitales s son más penetrantes que los p, este hecho hace que los dos carbonos del triple enlace sean más ácidos (aceptores de electrones) que los carbonos de los alcanos o alquenos.
Por esta razón, el triple enlace (≡) representa un punto específico para que especies donadoras de electrones se adicionen a él formando enlaces simples.
Esto trae como consecuencia la ruptura de uno de los enlaces π, convirtiéndose en un enlace doble (C=C). La adición continúa hasta obtenerse R4C-CR4, es decir, carbonos completamente saturados.
Lo anterior también puede explicarse de este modo: el triple enlace es una doble insaturación.
Fuerzas intermoleculares
Las moléculas de cicloalquinos interactúan mediante fuerzas de dispersión o fuerzas de London y por interacciones de tipo π-π. Estas interacciones son débiles, pero conforme aumenta el tamaño de los ciclos (como los tres últimos del lado derecho de la imagen), estos logran formar sólidos a temperatura y presión ambiente.
Tensión angular
Los enlaces en el triple enlace se ubican sobre un mismo plano y una línea. Por ende, -C≡C- tiene una geometría lineal, con los orbitales sp separados 180º aproximadamente.
Esto tiene una seria implicación en la estabilidad estereoquímica de los cicloalquinos. Se requiere de mucha energía para “doblar” los orbitales sp, ya que no son flexibles.
Mientras más pequeño es el cicloalquino, más deben doblarse los orbitales sp para permitir la existencia física del mismo. Analizando la imagen, puede notarse, de izquierda a derecha, que en el triángulo el ángulo de los enlaces a los lados del triple enlace es muy pronunciado; mientras que en el decágono son menos abruptos.
A medida que el cicloalquino es más grande, más se aproxima el ángulo de enlaces de los orbitales sp a los ideales 180º. Lo contrario ocurre cuando son más pequeños, forzando a doblarlos y creando una tensión angular en ellos, inestabilizando el cicloalquino.
Así, los cicloalquinos más grandes tienen menor tensión angular, lo cual posibilita sus síntesis y almacenamiento. Con esto, el triángulo es el cicloalquino más inestable, y el decágono el más estable de todos ellos.
Realmente, el ciclooctino (el del octágono) es el de menor tamaño más estable conocido; los demás solo existen como momentáneos intermediarios en las reacciones químicas.
Nomenclatura de los cicloalquinos
Para nombrar los cicloalquinos deben aplicarse las mismas normas regidas por la IUPAC que para los cicloalcanos y cicloalquenos. La única diferencia reside en el sufijo –ico al final del nombre del compuesto orgánico.
La cadena principal es aquella que posee el triple enlace, y se empieza a enumerar a partir del extremo más cercano a este. Si se tiene, por ejemplo, el ciclopropano, entonces al tener un triple enlace se llamará ciclopropino (el triángulo de la imagen). Si en el vértice superior tiene enlazado un grupo metil, entonces será: 2-metilciclopropino.
Los carbonos del R-C≡C-R ya tienen sus cuatro enlaces, por lo que carece de hidrógenos (como ocurre con todos los cicloalquinos de la imagen). Esto no ocurre únicamente si el triple enlace se halla en una posición terminal, esto es, en el extremo de una cadena (R-C≡C-H).
Aplicaciones de los cicloalquinos
Los cicloalquinos no son compuestos muy comunes, por lo que tampoco lo son sus aplicaciones. Pueden servir de ligantes (grupos que se coordinan) a los metales de transición, creando así una infinidad de compuestos organometálicos que pueden ser destinados a usos muy rigurosos y específicos.
Por lo general son solventes en sus formas más saturadas y estables. Cuando consisten en heterociclos, además de contar con unidades cíclicas C≡C-C=C-C≡C internas, encuentran interesantes y prometedores usos como fármacos anticancerosos; tal es el caso de la Dinemicina A. De ella se han sintetizado otros compuestos con analogías estructurales.
Ejemplos de cicloalquinos
La imagen muestra siete cicloalquinos simples, en los cuales apenas hay un triple enlace. De izquierda a derecha, con sus nombres respectivos se tienen: ciclopropino, el triángulo; ciclobutino, el cuadrado; ciclopentino, el pentágono; ciclohexino, el hexágono; cicloheptino, el heptágono; ciclooctino, el octágono; y ciclodecino, el decágono.
Con base en estas estructuras y sustituyendo los átomos de hidrógeno de los carbonos saturados, pueden obtenerse otros compuestos que deriven de ellos. Asimismo, pueden someterse a condiciones oxidativas para generar dobles enlaces en otros lados de los ciclos.
Estas unidades geométricas pueden formar parte de una estructura de mayor tamaño, aumentando las probabilidades de funcionalizar todo el conjunto. No son muchos los ejemplos disponibles de los cicloalquinos, al menos no sin profundizar en los terrenos de la síntesis orgánica y la farmacología.
Referencias
- Francis A. Carey. Química Orgánica. (Sexta edición., pág 372, 375). Mc Graw Hill.
- Wikipedia. (2018). Cycloalkyne. Tomado de: en.wikipedia.org
- William Reusch. (05 de mayo de 2013). Naming Organic Compounds. Tomado de: 2.chemistry.msu.edu
- Química inorgánica. Cicloalquinos. Tomado de: fullquimica.com
- Patrizia Diana & Girolamo Cirrincione. (2015). Biosynthesis of heterocycles from Isolation to Gene Cluster. Wiley, pag 181.
- Interesting Organic Chemistry and Natural Products. (17 de abril de 2015). Cycloalkynes. Tomado de: quintus.mickel.ch
