Fluoruro de magnesio: estructura, propiedades, síntesis, usos
El fluoruro de magnesio es una sal inorgánica incolora cuya fórmula química es MgF₂. Se encuentra en la naturaleza como el mineral sellaíta. Presenta un punto de fusión muy alto y es muy poco soluble en agua. Es relativamente inerte, pues, por ejemplo, su reacción con el ácido sulfúrico es lenta e incompleta y resiste la hidrólisis con el ácido fluorhídrico (HF) hasta los 750ºC.
Es un compuesto poco afectado por la radiación de alta energía. Además, posee un bajo índice de refracción, alta resistencia a la corrosión, buena estabilidad térmica, dureza significativa y excelentes propiedades de transmisión de luz visible, UV (ultravioleta) e IR (infrarroja).
Estas propiedades hacen que posea un excelente desempeño en el campo óptico y, además, lo convierten en un material útil como soporte de catalizadores, elemento de recubrimientos, lentes antirreflejo y ventanas para transmisión de infrarrojo, entre otras aplicaciones.
Índice del artículo
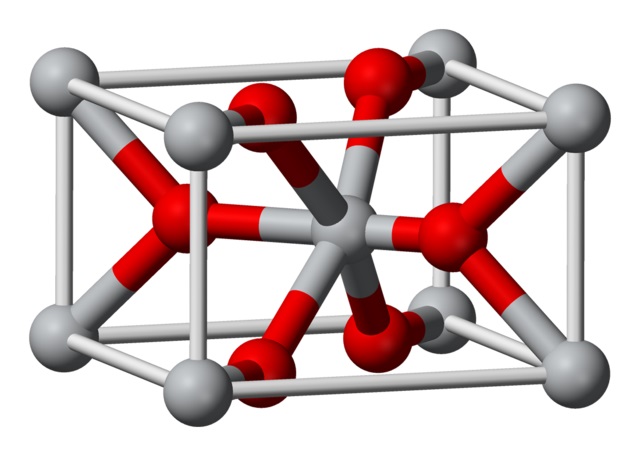
La estructura cristalina del fluoruro de magnesio preparado químicamente es del mismo tipo que la del mineral natural sellaíta. Cristaliza en la clase dipiramidal del sistema tetragonal.
Los iones de magnesio (Mg2+) están ubicados en un espacio-retícula tetragonal- centrado, mientras que los iones fluoruro (F-) se encuentran en el mismo plano de sus vecinos Mg2+ y asociados con estos, agrupados en pares con cada uno. La distancia entre los iones Mg2+ y F- es de 2,07 Å (angstroms) (2,07×10-10m).
Su coordinación cristalina es de 6:3. Esto significa que cada ion Mg2+ está rodeado por 6 iones F- y cada ion F-, a su vez, está rodeado por 3 iones Mg2+ 5.
La estructura es muy similar a la del mineral rutilo, que es la forma natural del dióxido de titanio (TiO2), con el cual posee varias propiedades cristalográficas en común.
Durante su obtención, el fluoruro de magnesio no precipita en forma de sólido amorfo, debido a que los iones Mg2+ y F- no tienden a formar complejos poliméricos en solución.
Es interesante destacar que el fluoruro de magnesio es un material birrefringente. Esta es una propiedad óptica que permite desdoblar un rayo de luz incidente en dos rayos separados que se propagan a velocidades y longitudes de onda diferentes.
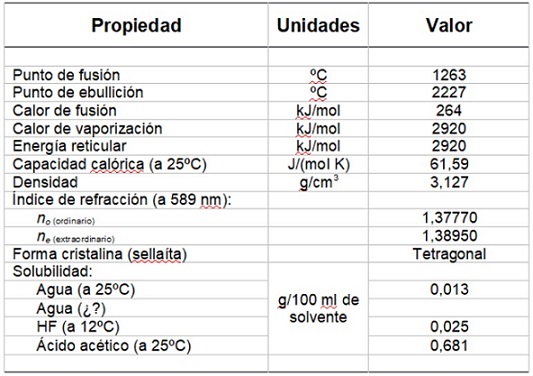
En la Tabla 1 se presentan algunas de sus propiedades.
Tabla 1. Propiedades físicas y químicas del fluoruro de magnesio.
Se puede preparar de varias formas, entre las que se pueden mencionar las siguientes:
1-Mediante la reacción entre el óxido de magnesio (MgO) o el carbonato de magnesio (MgCO3) con el ácido fluorhídrico (HF) 2:
MgO + 2 HF MgF2 + H2O
MgCO3 + 2 HF MgF2 + CO2 + H2O
2-Por reacción entre el carbonato de magnesio y el bifluoruro de amonio (NH4HF2), ambos en estado sólido, a una temperatura entre 150 y 400ºC2:
150-400ºC
MgCO3 + NH4HF2 MgF2 + NH3 + CO2 + H2O
3-Calentando una solución acuosa de carbonato de magnesio y fluoruro de amonio (NH4F) en presencia de hidróxido de amonio (NH4OH) a 60ºC 2:
60ºC, NH4OH
MgCO3 + 3 NH4F NH4MgF3 + (NH4)2CO3
El precipitado resultante de fluoruro de amonio y magnesio (NH4MgF3) se calienta luego a 620ºC durante 4 horas para obtener el fluoruro de magnesio:
620ºC
NH4MgF3 MgF2 + NH3 + HF
4-Como subproducto de la obtención del berilio (Be) y el uranio (U). Se calienta el fluoruro del elemento deseado con magnesio metálico en un crisol recubierto de MgF2 2:
BeF2 + Mg Be + MgF2
5-Haciendo reaccionar cloruro de magnesio (MgCl2) con fluoruro de amonio (NH4F) en solución acuosa a temperatura ambiente 3:
25ºC, H2O
MgCl2 + 2 NH4F MgF2 + 2NH4Cl
Dado que los métodos de preparación del MgF2 son costosos, hay intentos para obtenerlo de forma más económica, entre los que se destaca el método de producirlo partiendo de agua de mar.
Este se caracteriza por añadir suficiente cantidad de iones fluoruro (F-) al agua de mar, la cual presenta abundante concentración de iones magnesio (Mg2+), favoreciendo así la precipitación de MgF2.
Los cristales ópticos de fluoruro de magnesio se obtienen mediante presión en caliente de MgF2 en polvo de alta calidad, obtenido, por ejemplo, mediante el método del NH4HF2.
Existen muchas técnicas para preparar materiales de fluoruro de magnesio, tales como crecimiento de un solo cristal, sinterizado (compactación para moldear o dar forma) sin presión, prensado en caliente y sinterizado con microondas.
Los cristales de MgF2 son adecuados para aplicaciones ópticas debido a que son transparentes desde la región UV hasta la región IR media 2,10.
Como película inerte es empleado para alterar las propiedades de transmisión de luz de materiales ópticos y electrónicos. Una de las aplicaciones principales es en la óptica VUV para tecnología de exploración espacial.
Por su propiedad de birrefringencia este material es útil en la óptica de polarización, en ventanas y prismas del Láser Excimer (tipo de láser ultravioleta utilizado en cirugía ocular).
Hay que destacar que el fluoruro de magnesio empleado en la manufactura de materiales ópticos de película delgada debe estar libre de impurezas o compuestos que sean fuente de óxido, tales como agua (H2O), iones hidróxido (OH-), iones carbonato (CO3=), iones sulfato (SO4=), y similares 12.
El MgF2 ha sido empleado con éxito como soporte de catalizadores para la reacción de eliminación de cloro y adición de hidrógeno en los CFC (clorofluorocarbonos), conocidos refrigerantes y propulsores de aerosol, y responsables del daño a la capa de ozono de la atmósfera.
Los compuestos resultantes, HFC (hidrofluorocarbonos) y HCFC (hidroclorofluorocarbonos), no presentan este efecto dañino a la atmósfera 5.
También ha resultado útil como soporte de catalizadores para la hidrodesulfuración (eliminación de azufre) de compuestos orgánicos.
Los materiales generados por el intercalado de grafito, flúor y MgF2 presentan alta conductividad eléctrica, por lo que han sido propuestos para su empleo en cátodos y como materiales electroconductores.
El eutéctico formado por NaF y MgF2 presenta propiedades de almacenamiento de energía en forma de calor latente, por lo que ha sido considerado para su uso en sistemas de energía solar.
En el área de la bioquímica, el fluoruro de magnesio, junto a otros fluoruros metálicos, es utilizado para inhibir las reacciones de transferencia de fosforilo en enzimas.
Recientemente, las nanopartículas de MgF2 han sido probadas exitosamente como vectores de colocación de fármacos en células enfermas para el tratamiento del cáncer.
- Buckley, H.E. and Vernon, W.S. (1925) XCIV. The crystal structure of magnesium fluoride. Philosophical Magazine Series 6, 49:293, 945-951.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology, Volume 11, Fifth Edition, John Wiley & Sons. ISBN 0-471-52680-0 (v.11).
- Peng, Minhong; Cao, Weiping; and Song, Jinhong. (2015). Preparation of MgF2 Translucent Ceramic by Hot Pressing Sintering. Journal of Wuhan University of Technology-Mater: Sci. Ed. Vol. 30 No. 4.
- Непоклонов, И.С. (2011). Magnesium Fluoride. Source: Own work.
- Wojciechowska, Maria; Zielinski, Michal; and Pietrowski, Mariusz. (2003). MgF2 as a non-conventional catalyst support. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Magnesium Fluoride (MgF2). Consultado el 12/07/2019 en: korth.de
- Sevonkaev, Igor and Matijevic, Egon. (2009). Formation of Magnesium Fluoride Particles of Different Morphologies. Langmuir 2009, 25 (18), 10534-10539.
- Непоклонов, И.С. (2013). Magnesium Fluoride. Source: Own work.
- Tao Qin, Peng Zhang and Weiwei Qin. (2017). A novel method to synthesize low-cost magnesium fluoride spheres from seawater. Ceramics International 43 (2017) 14481-14483.
- Ullmann’s Encyclopedia of Industrial Chemistry (1996) Fifth Edition. Volume A11. VCH Verlagsgesellschaft mbH. New York. ISBN 0-89573-161-4.
- NASA (2013). Engineers inspecting the Hubble Space Telescope’s Primary Mirror 8109563. Fuente: mix.msfc.nasa.gov
