Hidrogenación catalítica: qué es, características, tipos, mecanismo
¿Qué es la hidrogenación catalítica?
La hidrogenación catalítica es la reacción química mediante la cual se adiciona hidrógeno molecular en un compuesto a mayores velocidades.
La molécula de H2 no solo debe primero romper su enlace covalente, sino que además, al ser tan pequeña, son menos probables las colisiones eficientes entre ella y el compuesto a donde se adicionará.
El compuesto receptor del hidrógeno bien puede ser orgánico o inorgánico. En los compuestos orgánicos son donde más se encuentran ejemplos de hidrogenación catalítica, en especial, aquellas que presentan actividad farmacológica, o que tienen incorporados metales en sus estructuras (compuestos organometálicos).
Cuando se adiciona H2 a una estructura repleta de carbono, lo que ocurre es que disminuye su insaturación, es decir, el carbono alcanza el grado máximo de enlaces simples que puede formar.
Por lo tanto, el H2 se adiciona a los dobles (C=C) y triples (C≡C) enlaces, aunque también puede adicionarse a los grupos carbonilos (C=O).
Así, los alquenos y alquinos reaccionan por hidrogenación catalítica. Analizando superficialmente cualquier estructura, puede predecirse si esta adicionará o no H2 con solo detectar dobles y triples enlaces.
Características de la hidrogenación catalítica
En la imagen se muestra el mecanismo de esta reacción. No obstante, es necesario abordar algunos aspectos teóricos antes de describirlo.
Las superficies de las esferas grisáceas representan los átomos metálicos que, como se verá, son los catalizadores de la hidrogenación por excelencia.
Rupturas del enlace de hidrógeno
– La hidrogenación es una reacción exotérmica, es decir, libera calor como resultado de la formación de compuestos con menor energía.
– Los enlaces C-H formados son estables, los cuales requieren de mayor energía para su posterior ruptura que la que necesita el enlace H-H del hidrógeno molecular.
– La hidrogenación siempre involucra primero la ruptura del enlace H-H. Esta ruptura puede ser homolítica, como ocurre en muchos casos:
H-H => H∙ + ∙H
O heterolítica, la cual puede darse, por ejemplo, cuando se hidrogena el óxido de zinc, ZnO:
H-H => H+ + H–
– La diferencia entre las dos rupturas radica en cómo se distribuyen los electrones del enlace. Si se reparten equitativamente (covalentemente), cada H termina conservando un electrón, mientras que si la repartición es de manera iónica, uno termina sin electrones, H+, y el otro los gana por completo, H–.
– Ambas rupturas son posibles en la hidrogenación catalítica, aunque la homolítica permite dar paso al desarrollo de un mecanismo lógico para esta.
Experimentales
– El hidrógeno es un gas, y por ende, debe burbujearse y garantizarse que solo él predomine sobre la superficie del líquido.
– El compuesto a hidrogenar tiene que solubilizarse en un medio, sea agua, alcohol, éter, ésteres o una amina líquida. De lo contrario, la hidrogenación transcurriría muy lentamente.
Disuelto el compuesto a hidrogenar, debe haber también un catalizador en el medio de reacción. Este será el responsable de acelerar la velocidad de la reacción.
– En la hidrogenación catalítica suele usarse metales finamente divididos de níquel, paladio, platino o rodio, los cuales son insolubles en casi todos los solventes orgánicos. Por lo tanto, habrá dos fases: una líquida con el compuesto y el hidrógeno disueltos, y una sólida, la del catalizador.
– Estos metales aportan su superficie para que el hidrógeno y el compuesto reaccionen, de tal modo que se agilizan los rompimientos de enlaces.
– Asimismo, disminuyen el espacio de difusión de las especies, aumentando el número de colisiones moleculares efectivas. No solo eso, sino que incluso la reacción toma lugar dentro de los poros del metal.
Tipos de hidrogenación catalítica
Homogénea
Se habla de hidrogenación catalítica homogénea cuando el medio de reacción consiste en una sola fase. Aquí no cabe lugar el uso de metales en sus estados puros, ya que son insolubles.
En vez de eso, se utilizan compuestos organometálicos de estos metales, que sí son solubles, y han demostrado tener altos rendimientos.
Uno de estos compuestos organometálicos es el catalizador de Wilkinson: cloruro de tris (trifenilfosfina) rodio, [(C6H5)3P]3RhCl.
Estos compuestos forman un complejo con el H2, activándolo para su posterior reacción de adición al alqueno o alquino.
La hidrogenación homogénea presenta muchas más alternativas que la heterogénea, porque la química en los compuestos organometálicos es abundante: basta con cambiar el metal (Pt, Pd, Rh, Ni) y los ligandos (las moléculas orgánicas o inorgánicas enlazadas al centro metálico), para obtener un nuevo catalizador.
Heterogénea
La hidrogenación catalítica heterogénea, como acaba de mencionarse, posee dos fases: una líquida y otra sólida.
Además de los catalizadores metálicos, existen otros que consisten de una mezcla sólida. Por ejemplo, el catalizador de Lindlar, que se compone de platino, carbonato de calcio, acetato de plomo y quinolina.
El catalizador de Lindlar tiene la particularidad de que es deficiente para la hidrogenación de los alquenos. Sin embargo, es de gran utilidad para hidrogenaciones parciales, es decir, funciona excelentemente sobre los alquinos:
RC≡CR + H2 => RHC=CHR
Mecanismo
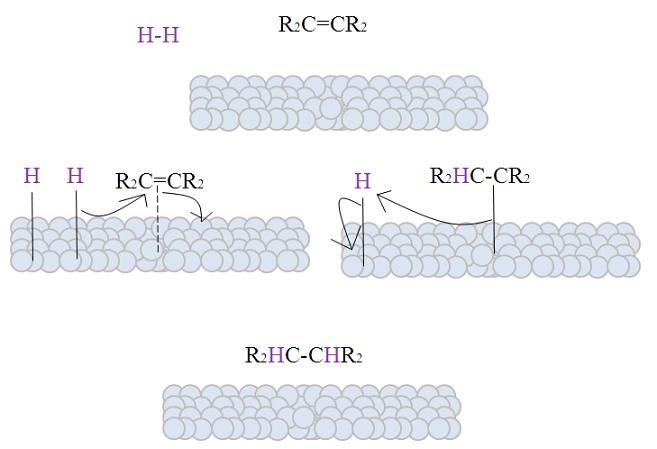
En la imagen se muestra el mecanismo de la hidrogenación catalítica utilizando como catalizador un metal pulverizado.
Las esferas grisáceas corresponden a la superficie metálica de, por decir, platino. La molécula H2 (color morado) se aproxima a la superficie metálica, al igual que el alqueno tetra sustituido, R2C=CR2.
El H2 interacciona con los electrones que recorren los átomos del metal, y ocurre una ruptura y formación de un enlace temporal H-M, donde M es el metal. A este proceso se le conoce como quimisorción. Es decir, una adsorción mediante fuerzas químicas.
El alqueno interacciona de un modo similar, pero el enlace lo forma con su doble enlace (línea punteada).
El enlace H-H ya se ha disociado y cada átomo de hidrógeno permanece enlazado al metal. Del mismo modo, lo hace con los centros metálicos en los catalizadores organometálicos, formando un complejo intermediario H-M-H.
Ocurre entonces una migración de un H hacia el doble enlace, y este se abre formando un enlace con el metal. Luego, el H restante se une al otro carbono del doble enlace original, y se libera finalmente el alcano producido, R2HC-CHR2.
Este mecanismo se repetirá tantas veces como sea necesario, hasta que todo el H2 haya reaccionado por completo.
Referencias
- Carey, F. (2008). Química Orgánica. Mc Graw Hill.
- Shiver & Atkins (2008). Química Inorgánica. Mc Graw Hill.
- Lew, J. (s.f.). Catalytic Hydrogenation of Alkenes. Recuperado de chem.libretexts.org
- What is Catalytic Hydrogenation? – Mechanism & Reaction. Recuperado de study.com
