Óxidos no metálicos: concepto, propiedades, tipos, ejemplos

¿Qué son los óxidos no metálicos?
Los óxidos no metálicos son compuestos binarios formados entre un no metal con estado de oxidación positivo y el oxígeno con estado de oxidación -2. También llamados anhídridos y óxidos ácidos, estos compuestos tienden a formar soluciones ácidas al disolverlos en agua, y además tienden a reaccionar con óxidos básicos para formar sales oxisales.
Los óxidos no metálicos son muy comunes en la naturaleza. De hecho, están por todas partes. El agua, el líquido vital que cubre las dos terceras partes de la superficie de la tierra, es un óxido no metálico. También lo son el dióxido de carbono que exhalamos durante nuestra respiración y los óxidos de azufre que contaminan el aire y que causan la lluvia ácida.
Al estar formados por no metales y oxígeno (que también es un no metal), los enlaces que unen a sus átomos son enlaces covalentes, en la mayoría de los casos poco polares. Por esta razón, la gran mayoría de los óxidos no metálicos o anhídridos poseen puntos de ebullición considerablemente bajos, y muchos de ellos son gases a temperatura ambiente.
Propiedades de los óxidos no metálicos
- No tienen lustre o brillo metálico.
- Pueden tener diversos colores.
- Sus átomos están unidos por medio de enlaces covalentes en lugar de enlaces iónicos.
- Están formados por oxígeno y un no metal.
- Comparados con los óxidos metálicos, suelen tener puntos de fusión y ebullición bajos, aunque muy diversos.
- La mayoría son gases, pero también se pueden encontrar en estado sólido (como el N2O3) o líquido a temperatura ambiente.
- Los óxidos no metálicos sólidos suelen ser quebradizos y pueden tener diferentes durezas.
- Son malos conductores del calor y la electricidad.
- Al disolverlos en agua, reaccionan para formar ácidos oxácidos.
- Algunos de sus ácidos oxácidos son ácidos fuertes que tienden a formar aniones u oxianiones en solución acuosa.
- Reaccionan con los óxidos básicos para formar sales oxisales.
Tipos de óxidos no metálicos
No existe una clasificación formal o universalmente aceptada de los óxidos no metálicos. Sin embargo, estos se pueden agrupar según sus propiedades ácido-base.
A pesar de que a los óxidos no metálicos también se les denomina óxidos ácidos, no todos ellos reaccionan siempre como ácidos frente a otros compuestos. En vista de esto, se pueden identificar tres tipos diferentes de óxidos no metálicos según sus propiedades ácido/base:
Óxidos no metálicos ácidos
Son por mucho los más comunes. La inmensa mayoría de los compuestos entre oxígeno y otro no metal, sin importar su estado de oxidación, producen ácidos minerales al disolverlos en agua, dando origen a soluciones ácidas.
- Algunos ejemplos de óxidos ácidos son el anhídrido nítrico (N2O5) y el anhídrido sulfúrico (SO3).
Óxidos no metálicos neutros
Algunos óxidos no metálicos no reaccionan con agua en absoluto al disolverse en ella. En estos casos, la solución resultante es neutra (no es ni ácida ni básica).
- Algunos ejemplos de óxidos neutros son el monóxido de carbono (CO), el óxido nitroso (N₂O) y el dióxido de cloro (ClO2).
Óxidos no metálicos anfóteros
El término anfótero se refiere a la capacidad de un compuesto químico de comportarse como ácido o como base, dependiendo de con quién reaccione. Es decir, se trata de compuestos que son tanto ácidos como bases al mismo tiempo.
- Entre los óxidos no metálicos anfóteros, el más común es el agua (H2O). El agua es anfótera, ya que es capaz de cederle un protón a una base (actuando ella como ácido), pero también es capaz de recibir un protón de un ácido (actuando ella como una base).
Ejemplos de óxidos no metálicos
A continuación se presentan los óxidos no metálicos más comunes de cada no metal, junto con su fórmula molecular, su nombre según la nomenclatura sistemática de la IUPAC, según la nomenclatura Stock y según la nomenclatura tradicional:
Los óxidos del carbono
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
CO | Monóxido de carbono | Óxido de carbono (II) | Anhídrido carbonoso |
CO2 | Dióxido de carbono | Óxido de carbono (IV) | Anhídrido carbónico |
Los óxidos del nitrógeno
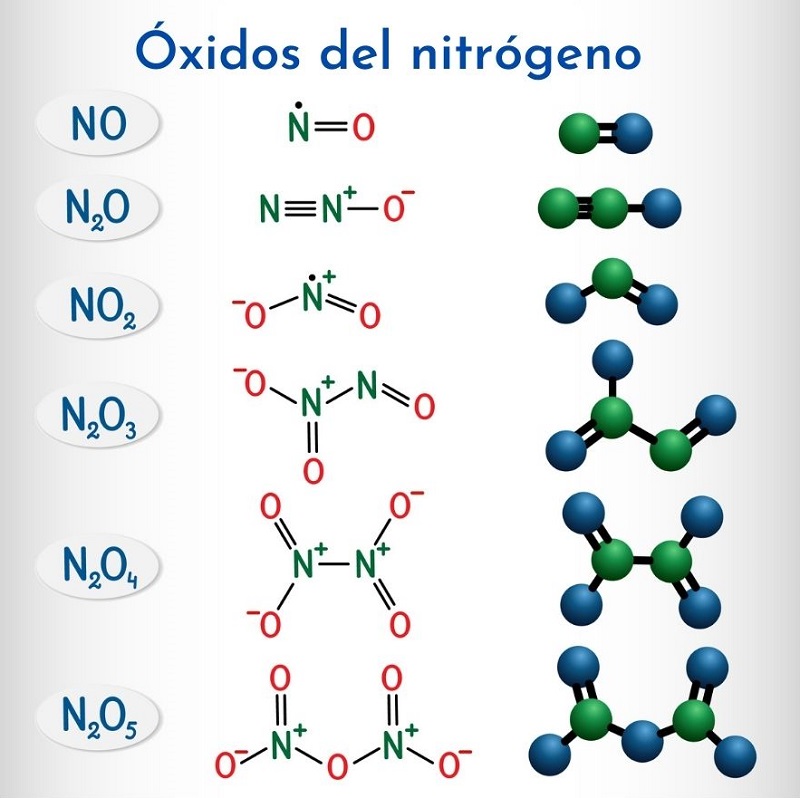
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
N2O | Monóxido de dinitrógeno | Óxido de nitrógeno (I) | Óxido nitroso (anhídrido hiponitroso) |
NO | Monóxido de nitrógeno | Óxido de nitrógeno (II) | Óxido nítrico |
N2O3 | Trióxido de dinitrógeno | Óxido de nitrógeno (III) | Anhídrido nitroso |
N2O4 | Tetraóxido de dinitrógeno | Óxido de nitrógeno(IV) | Tetraóxido de nitrógeno |
NO2 | Dióxido de nitrógeno | Óxido de nitrógeno (IV) | Dióxido de nitrógeno |
N2O5 | Pentaóxido de dinitrógeno | Óxido de nitrógeno (V) | Anhídrido nítrico |
Los óxidos del fósforo
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
P2O3 | Trióxido de difósforo | Óxido de fósforo (III) | Anhídrido fosforoso |
P2O5 | Pentaóxido de difósforo | Óxido de fósforo (V) | Anhídrido fosfórico |
P2O4 | Tetraóxido de difósforo | Óxido de fósforo (III,V) | --- |
Los óxidos del arsénico
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
As2O3 | Trióxido de diarsénico | Óxido de arsénico (III) | Anhídrido arsenioso |
As2O5 | Pentaóxido de diarsénico | Óxido de arsénico (V) | Anhídrido arsénico |
Los óxidos del antimonio
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
Sb2O3 | Trióxido de diantimonio | Óxido de antimonio (III) | Anhídrido antimonioso |
Sb2O5 | Pentaóxido de diantimonio | Óxido de antimonio (V) | Anhídrido antimónico |
Los óxidos del azufre
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
SO | Monóxido de azufre | Óxido de azufre (II) | Anhídrido hiposulfuroso |
SO2 | Dióxido de azufre | Óxido de azufre (IV) | Anhídrido sulfuroso |
SO3 | Trióxido de azufre | Óxido de azufre (VI) | Anhídrido sulfúrico |
Los óxidos del selenio
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
SeO | Monóxido de selenio | Óxido de selenio (II) | Anhídrido hiposelenioso |
SeO2 | Dióxido de selenio | Óxido de selenio (IV) | Anhídrido selenioso |
SeO3 | Trióxido de selenio | Óxido de selenio (VI) | Anhídrido selénico |
Los óxidos del telurio
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
TeO | Monóxido de telurio | Óxido de telurio (II) | Anhídrido hipoteluroso |
TeO2 | Dióxido de telurio | Óxido de telurio (IV) | Anhídrido teluroso |
TeO3 | Trióxido de telurio | Óxido de telurio (VI) | Anhídrido telúrico |
Los óxidos del cloro
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
Cl2O | Monóxido de cloro | Óxido de cloro (I) | Anhídrido hipocloroso |
Cl2O3 | Trióxido de cloro | Óxido de cloro (III) | Anhídrido cloroso |
Cl2O5 | Pentaóxido de cloro | Óxido de cloro (V) | Anhídrido clórico |
Cl2O7 | Heptaóxido de cloro | Óxido de cloro (VII) | Anhídrido perclórico |
Los óxidos del bromo
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
Br2O | Monóxido de bromo | Óxido de bromo (I) | Anhídrido hipobromoso |
Br2O3 | Trióxido de bromo | Óxido de bromo (III) | Anhídrido bromoso |
Br2O5 | Pentaóxido de bromo | Óxido de bromo (V) | Anhídrido brómico |
Br2O7 | Heptaóxido de bromo | Óxido de bromo (VII) | Anhídrido perbrómico |
Los óxidos del yodo
Fórmula | Nombre sistemático IUPAC | Nomenclatura Stock | Nombre tradicional |
I2O | Monóxido de yodo | Óxido de yodo (I) | Anhídrido hipoyodoso |
I2O3 | Trióxido de yodo | Óxido de yodo (III) | Anhídrido yodoso |
I2O5 | Pentaóxido de yodo | Óxido de yodo (V) | Anhídrido yódico |
I2O7 | Heptaóxido de yodo | Óxido de yodo (VII) | Anhídrido peryódico |
