Ácido carbónico (H2CO3): estructura, propiedades, síntesis, usos
El ácido carbónico es un compuesto inorgánico, aunque hay quienes debaten que en realidad es orgánico, cuya fórmula química es H2CO3. Es pues un ácido diprótico, capaz de donar dos iones H+ al medio acuoso para generar dos cationes moleculares H3O+. De él surgen los conocidos iones bicarbonato (HCO3–) y carbonato (CO32-).
Este ácido peculiar, simple, pero a la vez involucrado en sistemas donde participan numerosas especies en un equilibrio líquido-vapor, se forma a partir de dos moléculas inorgánicas fundamentales: el agua y el dióxido de carbono. La presencia del CO2 no disuelto se observa siempre que haya un burbujeo en el agua, ascendiendo hacia la superficie.

Dicho fenómeno se aprecia con suma regularidad en las bebidas gaseosas y el agua carbonatada.
En el caso del agua carbonatada o gasificada (imagen superior), se ha disuelto una cantidad tal de CO2 que su presión de vapor resulta más del doble que la presión atmosférica. Al destaparla, la diferencia de presión dentro de la botella y el exterior disminuye la solubilidad del CO2, por lo que aparecen las burbujas que terminan escapando del líquido.
En menor grado ocurre lo mismo en cualquier masa de agua dulce o salina: al calentarlas liberarán su contenido disuelto de CO2.
No obstante, el CO2 no se halla solamente disuelto, sino que sufre transformaciones en su molécula que lo convierten en el H2CO3; un ácido que tiene un tiempo de vida demasiado ínfimo, pero lo suficiente para marcar un cambio mesurable en el pH de su medio disolvente acuoso, y generar además un sistema buffer único de carbonatos.
Índice del artículo
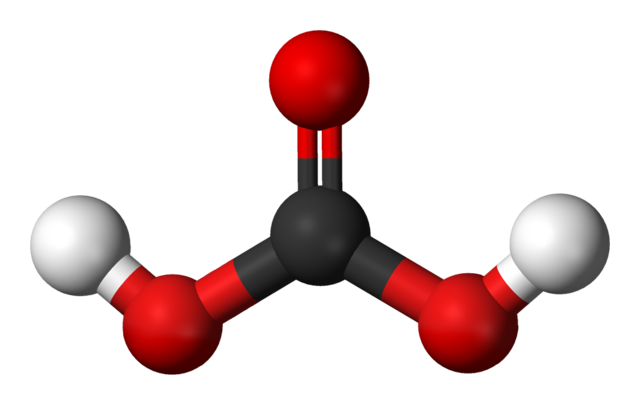
Arriba tenemos la molécula del H2CO3, representada con esferas y barras. Las esferas rojas corresponden a los átomos de oxígeno, la negra al átomo de carbono, y las blancas a los átomos de hidrógeno.
Nótese que partiendo de la imagen se puede escribir otra fórmula válida para este ácido: CO(OH)2, donde CO viene a ser el grupo carbonilo, C=O, enlazado a dos grupos hidroxilo, OH. Al haber dos grupos OH, capaces de donar sus átomos de hidrógeno, se entiende ahora de dónde provienen los iones H+ liberados al medio.
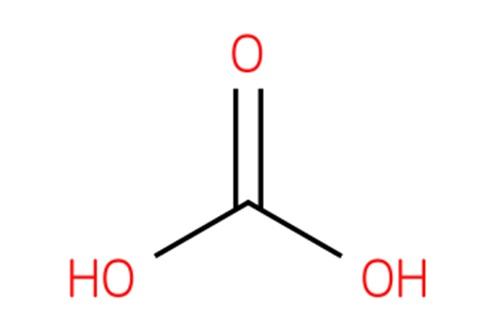
Nótese también que la fórmula CO(OH)2 puede escribirse como OHCOOH; es decir, del tipo RCOOH, donde R viene a ser en este caso un grupo OH.
Es por esta razón, además de que la molécula se compone de átomos de oxígeno, hidrógeno y carbono, demasiado comunes en química orgánica, que al ácido carbónico es considerado por algunos como un compuesto orgánico. Sin embargo, en el apartado de su síntesis se explicará por qué otros la consideran de naturaleza inorgánica y no orgánica.
De la molécula H2CO3 puede comentarse que su geometría es plano trigonal, con el carbono ubicado en el centro del triángulo. En dos de sus vértices posee los grupos OH, los cuales son donadores de puentes de hidrógeno; y en el otro restante, un átomo de oxígeno del grupo C=O, aceptor de puentes de hidrógeno.
Así pues, el H2CO3 tiene una fuerte tendencia a interaccionar con solventes próticos u oxigenados (y nitrogenados también).
Y casualmente, el agua cumple con estas dos características, y es tal la afinidad del H2CO3 por ella que casi inmediatamente le cede un H+ y comienza a establecerse un equilibrio de hidrólisis que involucra las especies HCO3– y H3O+.
Es por eso que la mera presencia del agua descompone el ácido carbónico y hace demasiado complicado su aislamiento como compuesto puro.
Volviendo a la molécula de H2CO3, no solo es plana, capaz de establecer puentes de hidrógeno, sino que además puede presentar isomería cis-trans; esta es, en la imagen tenemos al isómero cis, con los dos H apuntando en la misma dirección, mientras que en el isómero trans apuntarían en direcciones opuestas.
El isómero cis es el más estable de ambos, y es por eso que es el único que usualmente se representa.
Un sólido puro de H2CO3 consiste de una estructura cristalina compuesta por capas u hojas de moléculas interaccionando con puentes de hidrógeno laterales. Esto es de esperarse, siendo la molécula H2CO3 plana y triangular. Cuando sublima, aparecen dímeros cíclicos (H2CO3)2, los cuales se unen mediante dos puentes de hidrógeno C=O — OH.
La simetría de los cristales del H2CO3 no ha podido definirse por los momentos. Se consideró que cristalizaba como dos polimorfos: α-H2CO3 y β- H2CO3. Sin embargo, el α-H2CO3, sintetizado partiendo de una mezcla de CH3COOH-CO2, se demostró que era en realidad CH3OCOOH: un ester monometílico del ácido carbónico.
Se hizo mención que el H2CO3 es un ácido diprótico, por lo que puede donar dos iones H+ a un medio que los acepte. Cuando este medio es el agua, las ecuaciones de su disociación o hidrólisis son:
H2CO3(ac) + H2O(l) => HCO3–(ac) + H3O+(ac) (Ka1 = 2,5×10−4)
HCO3–(ac) + H2O(l) => CO32-(ac) + H3O+(ac) (Ka2 = 4,69×10−11)
El HCO3– es el anión bicarbonato o hidrogenocarbonato, y el CO32- el anión carbonato. Se indican además sus respectivas constantes de equilibrio, Ka1 y Ka2. Al ser Ka2 cinco millones de veces más pequeña que Ka1, la formación y concentración del CO32- son despreciables.
Así pues, aunque sea un ácido diprótico, el segundo H+ apenas puede liberarlo de modo apreciable. No obstante, la presencia del CO2 disuelto en grandes cantidades basta para acidificar el medio; en este caso, el agua, bajando sus valores de pH (por debajo de 7).
Hablar del ácido carbónico es referirse prácticamente a una disolución acuosa donde predominan las especies HCO3– y H3O+; no puede aislarse por métodos convencionales, pues el menor intento desplazaría el equilibrio de solubilidad del CO2 a la formación de burbujas que escaparían del agua.
El ácido carbónico es uno de los compuestos más fáciles de sintetizar. ¿Cómo? El método más simple consiste en burbujear, con ayuda de una pajilla o sorbete, el aire que exhalamos dentro de un volumen de agua. Debido a que exhalamos en esencia CO2, este burbujeará en el agua, disolviéndose una pequeña fracción del mismo.
Cuando hacemos esto ocurre la siguiente reacción:
CO2(g) + H2O(l) => H2CO3(ac)
Pero a su vez, debe considerarse la solubilidad del CO2 en el agua:
CO2(g) => CO2(ac)
Tanto el CO2 como el H2O son moléculas inorgánicas, por lo que el H2CO3 es inorgánico desde este punto visto.
Como resultado tenemos un sistema en equilibrio que depende enormemente de las presiones parciales del CO2, así como de la temperatura del líquido.
Por ejemplo, si la presión del CO2 se incrementa (en el caso de que soplamos el aire con más fuerza a través del sorbete), se formará más H2CO3 y el pH se tornará más ácido; ya que, el primer equilibrio se desplaza a la derecha.
Por otro lado, si calentamos la disolución de H2CO3, disminuirá la solubilidad del CO2 en el agua por ser un gas, y el equilibrio se desplazará entonces a la izquierda (habrá menos H2CO3). Similar será si intentamos aplicar un vacío: el CO2 escapará al igual que las moléculas de agua, las cuales volverían a desplazar el equilibrio hacia la izquierda.
Lo anterior permite llegar a una conclusión: a partir de una disolución de H2CO3 no hay modo de sintetizar este ácido como un sólido puro mediante un método convencional. Sin embargo, sí se ha hecho, desde la década de los 90 del siglo pasado, partiendo de mezclas sólidas de CO2 y H2O.
A esta mezcla sólida CO2-H2O al 50% se la bombardea con protones (un tipo de radiación cósmica), de manera que ninguno de los dos componentes escapará y ocurre la formación del H2CO3. Para este propósito también se ha utilizado una mezcla CH3OH-CO2 (recordar al α-H2CO3).
Otro método consiste en hacer lo mismo pero utilizando directamente hielo seco, nada más.
De los tres métodos los científicos de la NASA pudieron llegar a una conclusión: el ácido carbónico puro, sólido o gaseoso, puede existir en los satélites helados de Júpiter, en los glaciares marcianos, y en los cometas, donde tales mezclas sólidas son constantemente irradiadas por los rayos cósmicos.
El ácido carbónico por sí mismo es un compuesto sin ninguna utilidad. De sus disoluciones, no obstante, se pueden preparar soluciones amortiguadoras basadas en los pares HCO3–/CO32- o H2CO3/HCO3–.
Gracias a estas disoluciones y a la acción de la enzima anhidrasa carbónica, presente en los glóbulos rojos, el CO2 producido en la respiración puede transportarse en la sangre hasta los pulmones, donde se libera finalmente para ser exhalado fuera de nuestro organismo.
El burbujeo del CO2 se aprovecha para dotarle a las bebidas gaseosas la sensación agradable y característica que dejan en la garganta al beberlas.
Asimismo, la presencia del H2CO3 tiene importancia geológica en la formación de las estalactitas de piedra caliza, pues las disuelve lentamente hasta originar sus acabados puntiagudos.
Y por otro lado, sus disoluciones pueden utilizarse para preparar algunos bicarbonatos metálicos; aunque para ello sea más rentable y fácil emplear directamente una sal de bicarbonato (NaHCO3, por ejemplo).
El ácido carbónico tiene un tiempo de vida tan ínfimo en condiciones normales (estiman que alrededor de unos 300 nanosegundos), que prácticamente es inofensivo para el medio ambiente y los seres vivos. Sin embargo, como se dijo antes, eso no implica que no pueda generar un cambio preocupante en el pH del agua de los océanos, afectando la fauna marina.
Por otro lado, el verdadero “riesgo” se halla en la ingesta de agua gasificada, pues la cantidad de CO2 disuelta en ellas es mucho mayor que en el agua normal. Sin embargo, y nuevamente, no hay estudios que hayan demostrado que beber agua gasificada represente un riesgo mortal; si inclusive la recomiendan para ayunar y combatir la indigestión.
El único efecto negativo observado en quienes beben de esta agua es la sensación de llenura, pues sus estómagos se llenan de gases. Fuera de esto (sin mencionar los refrescos, ya que se componen de mucho más que solo ácido carbónico), puede decirse que este compuesto no es tóxico en lo absoluto.
- Day, R., & Underwood, A. (1989). Química Analítica Cuantitativa (quinta ed.). PEARSON Prentice Hall.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Carbonic acid. Recuperado de: en.wikipedia.org
- Danielle Reid. (2019). Carbonic Acid: Formation, Structure & Chemical Equation Video. Study. Recuperado de: study.com
- Götz Bucher & Wolfram Sander. (2014). Clarifying the structure of carbonic acid. Vol. 346, Issue 6209, pp. 544-545. DOI: 10.1126/science.1260117
- Lynn Yarris. (22 de octubre de 2014). New Insights on Carbonic Acid in Water. Berkeley Lab. Recuperado de: newscenter.lbl.gov
- Claudia Hammond. (14 de septiembre de 2015). Is sparkling water really bad for you? Recuperado de: bbc.com
- Jürgen Bernard. (2014). Solid and gaseous carbonic acid. Institute of Physical Chemistry. University of Innsbruck.
