Agar Müeller Hinton: fundamento, preparación y usos
El agar Müeller Hinton es un medio nutritivo sólido, no selectivo, que está compuesto por infusión de carne, peptona ácida de caseína, almidón, agar y agua destilada. Este medio permite un excelente desarrollo microbiano de la mayoría de las bacterias de crecimiento rápido.
Originalmente fue creado por John Howard Müeller y Jane Hinton para aislar bacterias exigentes desde el punto de vista nutricional, como Neisseria gonorrhoeae y Neisseria meningitidis. Sin embargo, debido a sus características resultó ser ideal para el estudio de la susceptibilidad a los antibióticos, proporcionando resultados confiables y reproducibles.
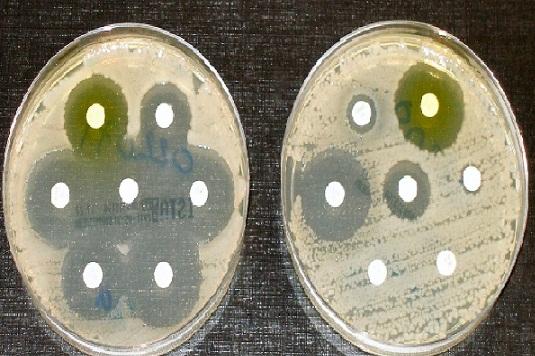
Por ello, el agar Müeller Hinton es el medio de cultivo aceptado por la Clinical and Laboratory Standards Institute (CLSI) y European Committee on Antimicrobial Susceptibility Testing, para la ejecución de la prueba de susceptibilidad antimicrobiana por el método de difusión en disco de Kirby y Bauer.
Índice del artículo
- 1 Fundamento
- 2 Preparación
- 3 Usos
- 4 Causas de resultados erróneos
- 5 Limitación
- 6 Control de calidad
- 7 Referencias
Por ser un medio nutritivo no selectivo es excelente para el crecimiento de la mayoría de las bacterias patógenas.
Por otra parte, su composición simple hace que las sustancias difundan fácilmente sobre él, siendo una característica esencial para la prueba de susceptibilidad por el método de difusión en disco.
Otra de sus características es que contiene baja cantidad de inhibidores, lo que permite que puedan evaluarse de manera efectiva las sulfonamidas, el trimetoprim y las tetraciclinas.
Sin embargo, se debe tener presente que el medio debe cumplir ciertas condiciones para garantizar su buen funcionamiento, entre ellas:
El ajuste del pH, la profundidad del agar y la concentración adecuada de timina, timidina, Ca++, Mg++ y Zn++.
También hay que saber que la metodología está estandarizada y por tanto deben cumplirse todos los parámetros, tales como:
La concentración del inóculo, la concentración y conservación de los discos de antibióticos, la colocación del número adecuado de discos sobre el agar, la distancia entre un disco y otro, la colocación estratégica de ciertos antibióticos, la atmósfera, la temperatura y el tiempo de incubación.
Pesar 37 gr del medio Müeller Hinton deshidratado y disolver en 1 litro de agua destilada. Calentar el medio mientras se agita para ayudar a su disolución. Dejar hervir por 1 minuto.
Llevar al autoclave para esterilizar a 121°C por 15 minutos. Al sacar del autoclave, se debe colocar la fiola en un baño de maría a 50°C para enfriar. Verter 25 a 30 ml en placas de Petri estériles de 10 cm de diámetro.
Las placas deben quedar con un grosor promedio de 4 mm (ideal), siendo permitido un rango de 3-5 mm.
Si se desea preparar agar sangre usando como base agar Müeller Hinton, se vierte 5% de sangre de cordero estéril y desfibrinada antes de servir en las placas.
El pH final del medio debe quedar entre 7,2 a 7,4.
Invertir y guardar en nevera, hasta su uso. Dejar que la placa tome temperatura ambiente antes de usar.
El color del medio preparado es beige claro.
Se utiliza para realizar el antibiograma o la prueba de susceptibilidad a los antibióticos a la mayoría de los patógenos no exigentes de crecimiento rápido.
Si el agar es suplementado con sangre sirve para realizar el antibiograma de microorganismos exigentes como: Streptococcus pneumoniae, Haemophilus sp, Neisseria meningitidis, entre otros. También ha sido utilizado para aislar Legionella pneumophila.
Antes de realizar el antibiograma se debe preparar una solución bacteriana equivalente a 1,5 x 108 células.
Para ello, se toman 3 a 4 colonias del cultivo puro y se suspenden en un caldo soya tripticasa o en caldo Müeller Hinton, se incuba por 2 a 6 horas y se ajusta la concentración con solución salina estéril, comparándolo con un patrón Mac Farland de 0,5%.
Si se tratan de microorganismos exigentes se pueden suspender colonias de forma directa hasta llegar a la concentración 0,5% de Mac Farland. Posteriormente, se siembra la placa de Müeller Hinton con un hisopo impregnado con la solución bacteriana preparada.
Para ello, se sumerge el hisopo en la solución y luego se quita el exceso de líquido haciendo presión contra las paredes del tubo. Inmediatamente después se pasa el hisopo por toda la superficie, sin dejar sitios sin tocar, luego se gira levemente la placa y se vuelve a sembrar. La operación se repite 2 veces más.
Deje reposar por 10 minutos y luego coloque los discos de antibióticos con una pinza estéril, dejando un espacio de 24 mm entre uno y otro. Después de colocar cada disco sobre el agar presione levemente a cada uno con la pinza para asegurar que queden bien adheridos.
Finalizado el proceso, se invierte la placa y se incuba a 35-37°C en aerobiosis por 16 a 18 horas. Si se trata de un microorganismo exigente puede ameritar microaerofilia y si el antibiograma contiene discos de oxacilina se debe leer a las 24 horas.
Para medir el diámetro de cada halo se utiliza una regla. Los resultados se deben anotar en mm. Posteriormente se correlacionan los valores obtenidos con las tablas de puntos de cortes publicadas por el manual de la CLSI vigente.

Reportar como sensible (S), intermedio (I), o resistente (R), según sea el caso.
Los antibióticos se seleccionan de acuerdo al microorganismo aislado y al tipo de infección que está produciendo.
En ocasiones se debe tener presente la colocación estratégica de antibióticos para evidenciar patrones fenotípicos de resistencia.
Para enterobacterias se debe colocar el disco de ácido clavulánico frente a cefalosporinas de 3er y 4ta generación. Un ensanchamiento en forma de huevo indica que la cepa es productora de betalactamasas de espectro extendido (BLEE). Esto significa que el paciente no debe ser tratado con ninguna cefalosporina.
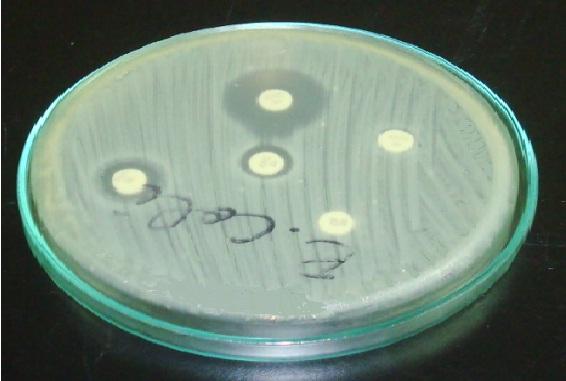
En Staphylococcus es importante colocar el disco de eritromicina o azitromicina frente al disco de clindamicina (prueba D-test).
Un halo resistente en eritromicina y un achatamiento en el halo de clindamicina indica que la cepa posee una resistencia inducible a clindamicina, cepa (RIC). Esto quiere decir que un tratamiento con clindamicina no será efectivo.
Para la búsqueda de cepas AMP C inducibles en enterobacterias y algunos bacilos Gram negativos no fermentadores, se enfrentan los discos de ceftazidime, cefoxitin o piperacilina tazobactan frente a un disco de imipenem, a una distancia de 27 mm.
Un halo achatado en alguno de los discos enfrentados a imipenem indica presencia de AMP C inducible.
Para la búsqueda de AMP C constitutiva se enfrenta un disco de cloxacilina 500 µg con ceftazidime (30 µg) y con cefotaxime (30 µg), a una distancia de 25 mm. Un halo ensanchado en alguna de las cefalosporinas indica positividad.
También se puede sustituir el disco de cloxacilina por un disco de 9 mm de papel de filtro Whatman N°6 impregnado con ácido fenil bórico (400 µg) con una distancia de 18 mm. Se interpreta igual al anterior.
Finalmente, para investigar la producción de metalobetalactamasas especialmente en Pseudomonas aeruginosa, se utiliza un disco impregnado con 10 µl de ácido etilendiamintetraacético (EDTA 750 µg) y ácido tioglicólico (SMA 300 µg), el cual se enfrenta con los discos de imipenem y meropenem, a una distancia de 15 mm.
La prueba es positiva si hay ensanchamiento de los halos de imipenem o meropenem hacia el disco de EDTA/SMA. Este resultado debe confirmarse por el test de Hodge modificado.
Este método consiste en inocular una cepa de Escherichia coli ATCC 25922 sobre la placa Müeller Hinton. Se coloca un disco de imipenem en el centro de la placa y luego se hace una estría desde el disco hacia la periferia con la cepa de P. aeruginosa sospechosa. Se pueden probar hasta 4 cepas por placa.
La prueba será positiva si hay una zona de distorsión del halo de imipenem alrededor de la estría.
-Discos de antibióticos mal conservados puede producir falsas resistencias. Por ejemplo, el disco de oxacilina es muy vulnerable a los cambios de temperatura.
-Un pH del medio por debajo al indicado (ácido) produce halos más pequeños en los aminoglucósidos y macrólidos (riesgo de falsa resistencia), y halos más grandes en la penicilina, tetraciclina y novobiocina (riesgo de falsa sensibilidad).
-Si el pH se encuentra por encima del indicado (alcalino) se invierten los efectos descritos anteriormente.
-Los medios con concentraciones de timina y timidina elevadas influyen reduciendo significativamente los halos de inhibición de las sulfonamidas y el trimetoprim.
-Altas concentraciones de calcio y magnesio producen falsas resistencia de los aminoglucósidos, polimixina B y tetraciclinas frente a cepas de Pseudomonas aeruginosa.
-Bajas concentraciones de calcio y magnesio producen falsas sensibilidades de los aminoglucósidos, polimixina B y tetraciclinas frente a cepas de Pseudomonas aeruginosa.
-La presencia de zinc afecta los resultados de los discos de carbapenems (imipenem, meropenem y ertapenem).
-El grosor del medio por debajo de 3 mm produce resultados de falsa sensibilidad, mientras que un grosor por encima de 5 producirá falsa resistencia.
-La movilización de discos en el antibiograma dará halos deformes, ya que la descarga de antibióticos es inmediata.
– Inóculos muy débiles afectan los resultados, pues no habrá un crecimiento uniforme o confluido en el agar, condición necesaria para poder medir los halos de inhibición, además de que los halos pueden dar más grande de lo normal.
-Inóculos demasiado cargados pueden dar halos más pequeños de lo normal.
-No respetar la distancia entre discos hace que se superponga un halo con otro y no se puedan leer correctamente.
-Incubar con CO2 aumenta el tamaño de los halos de los discos de tetraciclina y meticilina.
-Incubar a temperaturas por debajo de 35°C produce halos más grandes.
-El agregado de sangre disminuye el tamaño del halo de las sulfamidas.
La sensibilidad de un antibiótico demostrada en el antibiograma frente a un microorganismo (in vitro) no es garantía de que funcionará in vivo.
Para saber si el medio contiene la cantidad adecuada de timina, se debe sembrar una cepa de Enterococcus faecalis ATCC 29212 y probar la susceptibilidad a trimetoprim sulfametoxazol (SXT), el mismo debe dar un halo igual o > a 20 mm para que sea satisfactorio.
- “Agar Müller-Hinton.” Wikipedia, La enciclopedia libre. 16 nov 2018, 12:23 UTC. 27 ene 2019, 04:22
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Cona E. Condiciones para un buen estudio de susceptibilidad mediante test de difusión en agar. Rev Chil Infect, 2002; 19 (2): 77-81
- Laboratorio Difco Francisco Soria Melguizo. Müeller Hinton agar with 5% sheep blood. 2009. Disponible en: http://f-soria.es
- Laboratorio BD Müeller Hinton II Agar. 2017. Disponible en: .bd.com
- Laboratorios Britania. Müeller Hinton agar. 2015. Disponible en: britanialab.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. 5ta ed. Editorial Panamericana S.A. Argentina.
- Martínez-Rojas D. Betalactamasas tipo AmpC: Generalidades y métodos para detección fenotípica. Rev. Soc. Ven. Microbiol. 2009; 29 (2): 78-83. Disponible en: scielo.org.
- Perozo A, Castellano M, Ling E, Arraiz N. Detección fenotípica de metalobetalactamasas en aislados clínicos de Pseudomonas aeruginosa. Kasmera, 2012; 40 (2): 113-121. Disponible en: scielo.org.
