Metilamina: estructura, propiedades, producción, usos
La metilamina es un compuesto orgánico cuya fórmula condensada es CH3NH2. Específicamente se trata de la alquilamina primaria más simple de todas, pues solo contiene un sustituyente alquílico, lo cual es igual a decir que solo hay un enlace covalente C-N.
En condiciones normales es un gas amoniacal que huele a pescado, pero que es relativamente fácil de condensar y transportar en tanques herméticos. Asimismo, puede disolverse apreciablemente en agua, originando soluciones amarillentas. Por otro lado, también puede transportarse como sólido en forma de su sal de clorhidrato, CH3NH2·HCl.
La metilamina se produce industrialmente a partir del amoníaco y metanol, aunque existen otros muchos métodos de producción a escalas de laboratorio. Su gas es altamente explosivo, por lo que cualquier fuente de calor cercano a él tiene el potencial de ocasionar un gran incendio.
Es un compuesto con alta demanda comercial, pero que al mismo tiempo presenta fuertes restricciones legales debido a que sirve como materia prima para fármacos y sustancias psicotrópicas.
Índice del artículo
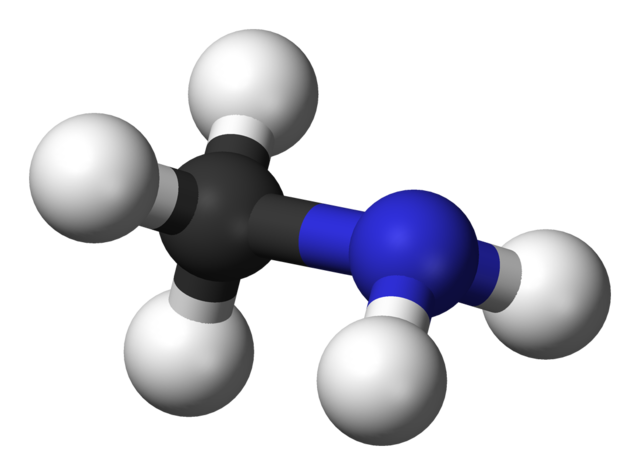
La imagen de arriba muestra la estructura molecular de la metilamina representada por un modelo de esferas y barras. La esfera negra corresponde al átomo carbono, la azul al átomo de nitrógeno, y las blancas a los átomos de hidrógeno. Se trata pues, de una molécula pequeña, donde el metano, CH4, pierde un H por un grupo NH2, dando CH3NH2.
La metilamina es una molécula altamente polar, debido a que el átomo de nitrógeno atrae densidad electrónica del carbono y los átomos de hidrógeno. Tiene la capacidad además de formar puentes de hidrógenos entre el compendio de sus fuerzas intermoleculares. Cada molécula de CH3NH2 puede donar o aceptar un puente de hidrógeno consecutivo (CH3HNH—NH2CH3).
No obstante, su masa molecular es considerablemente baja, además de que las porciones CH3 obstaculizan en dichos puentes de hidrógeno. El resultado es que la metilamina es un gas en condiciones normales, pero que puede condensarse a una temperatura de -6 ºC. Cuando cristaliza, lo hace siguiendo una estructura ortorrómbica.
Gas o líquido incoloro, pero cuyas soluciones acuosas pueden presentar tonalidades amarillentas.
Desagradable, parecido al de una mezcla de pescado y amoníaco.
31,058 g/mol
-93,10 ºC
Alrededor de los -6 ºC. Por lo tanto, es un gas que puede condensarse a temperaturas no demasiado frías.
656,2 kg/m3 a 25 ºC. Sus vapores son 1,1 veces más densos que el aire, mientras que su líquido o condensado es cerca de 0,89 veces menos denso que el agua.
A temperatura ambiente su presión de vapor oscila las 3,5 atm.
1,31 D
1.080 g/L a 20 ºC. Es un gas que se disuelve muy bien en agua, debido a que ambas moléculas son polares y afines entre sí al establecer puentes de hidrógeno (CH3HNH—OH2).
La metilamina tiene una constante de basicidad (pKb) de 3,36. Este valor indica que es una sustancia considerablemente básica, incluso más que el mismo amoníaco, por lo que disuelta en agua libera cierta cantidad de iones OH– al hidrolizarse:
CH3NH2 + H2O ⇌ CH3NH3+ + OH–
La metilamina es más básica que el amoníaco porque su átomo de nitrógeno presenta mayor densidad electrónica. Esto se debe a que el CH3 dona más electrones al nitrógeno que los tres átomos de hidrógeno en la molécula de NH3. Aun así, la metilamina se considera una base débil frente a otras alquilaminas o aminas.
-10 ºC a copa cerrada, lo que significa que es un gas altamente inflamable y peligroso.
430 ºC
19,15 mN/m a 25 ºC
Cuando arde se descompone térmicamente en óxidos de carbono y nitrógeno, los cuales forman un humo tóxico.
La metilamina puede producirse o sintetizarse ya sea por el método comercial o industrial, o por métodos de laboratorio a menores escalas.
La metilamina se produce industrialmente mediante la reacción que toma lugar entre el amoníaco y el metanol sobre un soporte catalítico de sílice gel. La ecuación química para esta reacción es la siguiente:
CH3OH + NH3 → CH3NH2 + H2O
En el proceso pueden generarse otras alquilaminas; sin embargo, la metilamina es el producto que cinéticamente se ve más favorecido.
A nivel de laboratorio existen varios métodos que permiten sintetizar la metilamina a pequeña escala. Uno de ellos es la reacción en medio básico fuerte, de KOH, entre la acetamida y el bromo, durante la cual se genera isocianato de metilo, CH3NCO, que a su vez se hidroliza para convertirse en la metilamina.
La metilamina puede guardarse como un sólido si se neutraliza con ácido clorhídrico, de manera que se forme una sal de clorhidrato:
CH3NH2 + HCl → CH3NH2·HCl
Luego, el clorhidrato de metilamina, también representado como [CH3NH3]Cl, puede basificarse en un sitio seguro para obtenerse la solución acuosa con el gas disuelto:
[CH3NH3]Cl + NaOH → CH3NH2 + NaCl + H2O
Por otra parte, la metilamina también puede sintetizarse partiendo de la hexamina, (CH2)6N4, la cual se hidroliza directamente con el ácido clorhídrico:
(CH2)6N4 + HCl + 6 H2O → 4 NH4Cl + 6 CH2O
Consecutivamente, el cloruro de amonio reacciona con el formaldehído en caliente para originar la metilamina y vapores de ácido fórmico, HCOOH.
Asimismo, la metilamina puede obtenerse mediante la reducción del nitrometano, CH3NO2 con zinc metálico y ácido clorhídrico.

La metilamina es un compuesto cuyos usos suelen generar controversia, pues es una sustancia empleada en la síntesis de narcóticos como la metanfetamina. De hecho, su popularidad se debe al afán que tenían los protagonistas de la serie de televisión Breaking Bad por conseguirla a cualquier costo.
Este compuesto también se utiliza como materia prima para la producción de insecticidas, fármacos, surfactantes, explosivos, colorantes, fungicidas, aditivos, etc., por lo que tiene una fuerte demanda mundial, además de múltiples restricciones legales para su adquisición.
Su inmensa versatilidad química se debe a que su molécula CH3NH2 es un buen agente nucleofílico, enlazándose o coordinándose a sustratos de mayor masa molecular en varias reacciones orgánicas. Por ejemplo, en esto se basa la síntesis de la efedrina, en donde el CH3NH2 se incorpora a una molécula con la consecuente pérdida de un H.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Methylamine. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Methylamine. PubChem Database., CID=6329. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Dylan Matthews. (15 de agosto de 2013). Here’s what ‘Breaking Bad’ gets right, and wrong, about the meth business. Recuperado de: washingtonpost.com
- Prepchem. (2020). Preparation of methylamine hydrochloride. Recuperado de: prepchem.com
