Óxido de titanio (IV): estructura, propiedades, usos
El óxido de titanio (IV) es un sólido inorgánico blanco cristalino cuya fórmula química es TiO2, por lo que también se le conoce como dióxido de titanio. Existe en tres formas cristalinas: rutilo, anatasa y brookita. Aunque en la naturaleza es usualmente coloreado debido a la presencia de impurezas como hierro, cromo o vanadio, el TiO2 puro es usado como pigmento blanco.
Entre sus características podemos destacar que la solubilidad del TiO2 depende considerablemente de su historia química y térmica. Así como que cuando se calienta a altas temperaturas (900 ºC) se vuelve químicamente inerte. Sus fuentes más importantes son la ilmenita (óxido de hierro y titanio), el rutilo y la anatasa.

Se produce principalmente en un grado adecuado para su uso como pigmento, lo que garantiza sus excelentes propiedades de dispersión de luz en aplicaciones que requieren opacidad blanca y brillo.
También se produce como material ultrafino, para aplicaciones en las que se requiere transparencia y máxima absorción de rayos ultravioleta (UV). Por ejemplo, como componente de los protectores solares para la piel. En estos, el TiO2 actúa como filtro, bloqueando así la absorción de estos rayos.
Por su inercia química, es el pigmento blanco preferido. Sin embargo, la Administración de Alimentos y Drogas de los Estados Unidos, o FDA (siglas del inglés U.S. Food and Drug Administration), ha establecido los parámetros para su uso seguro en alimentos y cosméticos.
Existe también un límite de exposición al polvo de óxido de titanio, ya que al inhalarse el polvo este puede depositarse en los pulmones.
Índice del artículo
El TiO2 posee tres modificaciones cristalinas: rutilo, anatasa y brookita. Estas variedades cristalinas se encuentran todas en la naturaleza.
El rutilo cristaliza en el sistema tetragonal con dos unidades TiO2 por cada celda. El titanio se encuentra coordinado octaédricamente. Se ha demostrado por estudios calorimétricos que el rutilo es la forma cristalina más térmicamente estable.
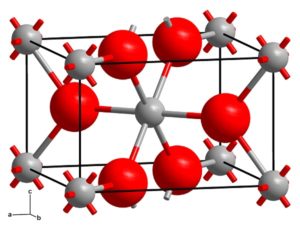
También esta forma cristaliza en el sistema tetragonal, pero la anatasa se presenta en forma de octaedros muy distorsionados de átomos de oxígeno con respecto a cada átomo de titanio, siendo dos de ellos relativamente más cercanos. Posee 4 unidades de TiO2 por cada celda cristalina.
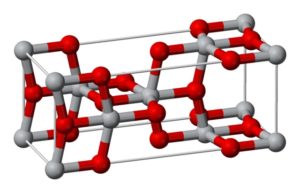
Cristaliza en el sistema ortorrómbico, con 8 unidades TiO2 por cada celda cristalina.
Sólido cristalino.
Rutilo: 7-7,5.
Anatasa: 5,5-6.
79,87 g/mol.
Rutilo: 1830-1850 ºC.
Anatasa: al calentar se convierte en rutilo.
Rutilo: 4,250 g/cm3
Anatasa: 4,133 g/cm3
Brookita: 3,895 g/cm3
Insoluble en agua y solventes orgánicos. Se disuelve lentamente en HF y en H2SO4 concentrado caliente. Insoluble en HCl y en HNO3.
7,5.
Rutilo: 2,75 a 550 nm.
Anatasa: 2,54 a 550 nm.
Tiene el índice de refracción más alto de todos los pigmentos inorgánicos.
La anatasa se transforma rápidamente en rutilo a temperaturas superiores a los 700 ºC. El TiO2 que ha sido calcinado a 900 ºC se disuelve débilmente en bases, ácido fluorhídrico y ácido sulfúrico caliente. No es atacado por ácidos inorgánicos débiles ni ácidos orgánicos. No es reducido fácilmente ni oxidado.
La anatasa y el rutilo son semiconductores en banda ancha, pero su conductividad eléctrica depende de la presencia de impurezas y defectos en el cristal.
-Dióxido de titanio
-Rutilo
-Anatasa
-Brookita
-Titania
El uso más importante del óxido de titanio (IV) es como pigmento blanco en una gran variedad de productos, los cuales incluyen pinturas, lacas, adhesivos, plásticos, papel y tintas de impresión. Esto se debe a su alto índice de refracción y a su inercia química.

El dióxido de titanio utilizado como pigmento blanco debe poseer una alta pureza. Su opacidad y brillo se derivan de su capacidad para dispersar la luz. Es más brillante que el diamante. Solo el rutilo y la anatasa poseen buenas propiedades de pigmentación.
En los plásticos el TiO2 minimiza la fragilidad y el agrietamiento que puede ocurrir como resultado de la exposición a la luz.
Es el pigmento más importante en la manufactura de los artículos de plástico de PVC para exteriores, debido a que proporciona protección UV al material.
La forma cristalina óptima en este caso es el rutilo. En dicha aplicación, el rutilo debe poseer un recubrimiento superficial de circonio, sílice o aluminio, para minimizar del efecto fotocatalítico del TiO2 en la degradación del PVC.
Otros usos incluyen esmaltes vítreos usados en acero y hierro fundido, a los que confiere opacidad y resistencia a los ácidos.
En la industria textil se emplea en las guías de hilo, para que se deslicen fácilmente durante el hilado. La fricción entre los hilos y las guías genera electricidad estática. Para disiparla, el TiO2 debe ser quemado a 1300 ºC, con el objeto de que posea una mayor conductividad eléctrica.
Otras aplicaciones incluyen la pigmentación de tintas para impresión, goma, textiles, cuero, fibras sintéticas, cerámicas, cemento blanco, recubrimiento de pisos y materiales para techos. Como recubrimiento de papel, el TiO2 lo hace más blanco, brillante y más opaco.
Se emplea en cosméticos para ayudar a cubrir imperfecciones de la piel, así como para dar el color blanco a la pasta de dientes y en jabón.
Permite proteger alimentos, bebidas, suplementos y productos farmacéuticos de la degradación prematura producida por el efecto de la luz, alargando la vida del producto.
Es un componente en la producción de vidrio, cerámicas y electrocerámicas. Se emplea en elementos de circuitos eléctricos. También se usa en el sensor de oxígeno del sistema de escape de los vehículos automotores.
El TiO2 ultrafino se usa como componente de los bloqueadores solares, ya que es un fuerte absorbente de los rayos ultravioleta (UV), tanto los UV-A como los UV-B. Los rayos UV-A causan arrugas y envejecimiento de la piel, y los UV-B causan quemaduras y eritemas.
Las nanopartículas de TiO2 se emplean como material de soporte de catalizadores de reacciones químicas.
La anatasa es un efectivo fotocatalizador que oxida los compuestos orgánicos. Mientras menores son sus partículas, más efectiva es.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volume 19 and 24. Fourth Edition. John Wiley & Sons.
- Chemical Safety Facts. (2019). Titanium Dioxide. Recuperado de: chemicalsafetyfacts.org
- Wypych, George. (2015). PVC Additives. In PVC Formulary (Second Edition). Recuperado de sciencedirect.com
- Denning, R. (2009). Enhancing wool products using nanotechnology. In Advances in Wool Technology. Recuperado de sciencedirect.com
- National Library of Medicine. (2019). Titanium Dioxide. Recuperado de: pubchem.ncbi.nlm.nih.gov
