Ácido maleico: estructura, propiedades, obtención, usos
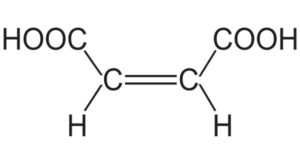
El ácido maleico es un compuesto orgánico ácido cuya fórmula química es HOOC-CH=CH-COOH. Es un ácido dicarboxílico. Se le conoce también como ácido cis-butenodioico, ácido maleínico, ácido malénico y ácido toxílico.
El ácido maleico se encuentra de forma natural en el tabaco, en el ginseng y en bebidas como la cerveza y el vino. También se encuentra en el humo del cigarrillo y en los gases de escape de los automóviles.
Su doble enlace y los dos grupos –COOH lo hacen susceptible de varias reacciones químicas, por lo que sirve para sintetizar muchos otros compuestos, materiales y productos.
Además es de gran ayuda para el procesamiento de textiles como algodón, lana y seda. Permite obtener pegamentos, resinas y aceites sintéticos. Se emplea para evitar la oxidación de grasas y aceites. A su vez, muchos de sus derivados se utilizan en aplicaciones médicas y veterinarias.
Según ciertas investigaciones es uno de los componentes de las bebidas fermentadas que estimula la secreción de ácido gástrico.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Usos del ácido maleico
- 6 Efectos del ácido maleico contenido en bebidas fermentadas como la cerveza y el vino
- 7 Riesgos
- 8 Referencias
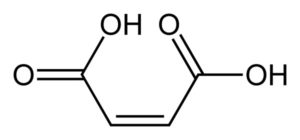
La molécula del ácido maleico está formada por un esqueleto de 4 átomos de carbono, de los cuales los dos de los extremos forman grupos carboxilo –COOH y los dos centrales forman un doble enlace C=C.
Los grupos –COOH están ubicados en posición cis con respecto al doble enlace. Los oxígenos e hidrógenos de los –COOH se acomodan de manera que entre los oxígenos queda ubicado un hidrógeno.
– Ácido maleico
– Ácido cis-butenodioico
– Ácido toxílico
– Ácido maleínico
– Ácido malénico
Sólido cristalino incoloro, cristales monoclínicos.

116,07 g/mol
130,5 ºC
135 ºC (se descompone)
1,609
Muy soluble en agua: 79 g/100 g H2O a 20 ºC
K1 = 1000 x 10-5
K2 = 0,055 x 10-5
El ácido maleico presenta como sitios reactivos dos grupos –COOH y un doble enlace C=C central.
Su anhídrido es una molécula cíclica de 5 átomos, cuyos productos son inestables hacia la hidrólisis, en especial los productos de reacción con grupos amino –NH2.
Esto hace que sirva como bloqueador reversible de grupos –NH2 para enmascararlos temporalmente y evitar que reaccionen cuando se están efectuando otras reacciones.
Esto es útil para múltiples propósitos, en especial, para modificar proteínas a nivel de laboratorio.
Industrialmente se obtiene mediante la oxidación catalítica del benceno en presencia de pentóxido de vanadio.
También por oxidación del n-butano o del n-butileno en fase de vapor con aire, en presencia de un catalizador sólido.
Se puede obtener también por la hidrólisis del anhídrido maleico.
Además se obtiene como subproducto durante la manufactura del anhídrido ftálico partiendo del naftaleno.
El ácido maleico permite obtener muchos otros compuestos químicos. Se usa en la síntesis de ácido aspártico, málico, tartárico, succínico, láctico, malónico, propiónico y acrílico.
Como intermediario químico el ácido maleico encuentra uso en casi todos los campos de la química industrial.
El ácido maleico permite obtener pegamentos sintéticos, colorantes, resinas alquídicas y aceites sintéticos.
Sus derivados las sales de maleato se usan en formulaciones antihistamínicas y medicamentos similares.
Se utiliza como conservante en grasas y aceites pues sirve para retardar la aparición de rancidez.
Se usa en inhibidores de corrosión y productos anti-incrustaciones. Funciona también como agente para regular el pH.
Se emplea en el procesamiento de la lana, la seda y el algodón.
Se ha investigado la obtención de oligómeros (polímeros de pocas unidades) del ácido maleico para utilizarlos como un agente de acabado en la obtención de algodón de planchado permanente, para no emplear polímeros de formaldehido.
En este caso, la polimerización del ácido maleico se realiza en medio acuoso en presencia de NaH2PO2 y un iniciador de radicales como el Na2S2O8. El oligómero del ácido maleico posee grupos carboxilo –COOH unidos a los –CH2– adyacentes de su esqueleto molecular.
Se aplica a la tela de algodón como agente de formación de retícula y se realiza el proceso de curado.
De esta forma el oligómero de ácido maleico resulta efectivo para entrecruzar la celulosa del algodón e impartir altos niveles de resistencia a las arrugas a las telas de algodón.
Además las telas tratadas con los polímeros de ácido maleico no presentaron amarillamiento y mostraron mayor retención de fuerza o resistencia que las tratadas con polímeros de formaldehido.

Existen diversos compuestos basados en ácido maleico que se emplean en el tratamiento contra el cáncer.
El maleato de Sunitinib (Sutent) es un medicamento anticancerígeno que actúa de varias formas para inhibir la proliferación de las células de los tumores y la angiogénesis.
Está aprobado para el tratamiento del carcinoma de células renales y el tumor gastrointestinal resistente a otros medicamentos. Se está investigando su actividad en el carcinoma hepatocelular y cáncer de células de pulmón. Se suministra oralmente en cápsulas.
Según un estudio realizado en 2015, se prepararon unas nanopartículas con un copolímero de estireno-ácido maleico al cual se unió vía enlace tipo éster el medicamento Paclitaxel usado para el tratamiento de cáncer.
Estas nanopartículas mostraron una mayor retención en el plasma y en el tumor, inhibiendo el crecimiento de este último con mejoramiento del efecto de apoptosis (muerte) de células cancerígenas.
No mostraron toxicidad en los órganos principales, tejidos y sistema hematológico.
Por estas razones se proponen como un sistema alternativo de distribución o liberación del medicamento en tumores sólidos
Según ciertas investigaciones, el ácido maleico al 10% disminuye la pérdida mineral de los dientes cuando se aplica en tratamientos dentales.
Se utiliza para erosionar suavemente la superficie dental y así favorecer la adhesión de otros materiales.
Se reporta que puede producir fuerzas de unión o adhesión iguales que con ácido ortofosfórico al 37%.
El maleato de acepromazina se usa como tranquilizante en medicina veterinaria para la sedación de los animales antes de la anestesia. Este compuesto protege contra efectos generadores de arritmias de la anestesia.
Se ha encontrado recientemente (2018) que el ácido maleico puede inhibir la resistencia de la bacteria Listeria monocytogenes a los ácidos haciéndola susceptible a la acción de estos cuando se utilizan para desinfectar en industrias de alimentos.
Se cree que actúa sobre una enzima que favorece la resistencia de esos microorganismos a los ácidos, desactivándola. Se ha observado también que el ácido maleico elimina las biopelículas de tales bacterias.
Estas características lo hacen un candidato potencial para la desinfección de equipos en la industria alimenticia.
Estudios realizados con humanos que ingirieron soluciones de glucosa fermentada encontraron que los ácidos dicarboxílicos como el ácido maleico son poderosos estimulantes del ácido gástrico.
Según los investigadores es muy probable que esto ocurra en el caso de bebidas fermentadas como la cerveza, la champaña y el vino, pero no en bebidas alcohólicas destiladas como el whisky y el coñac.
Esto se debe a que el efecto estimulante del ácido gástrico es causado por los ácidos dicarboxílicos como el ácido maleico y no por el alcohol (etanol).
El contacto de ácido maleico con los ojos o la piel causa irritación y puede producir dermatitis bajo contacto prolongado. Su inhalación produce irritación de nariz y garganta. Puede ejercer efecto dañino en los riñones.
Al ser expuesto a calor o llama ocurre su combustión y los gases o humos producidos causan irritación.
Si el ácido maleico es liberado, al ambiente se espera sea fraccionado o descompuesto por los microorganismos. No se acumula en organismos acuáticos.
- U.S. National Library of Medicine. (2019). Maleic Acid. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Hermanson, G.T. (2013). Functional Targets for Bioconjugation. In Bioconjugate Techniques (Third Edition). Recuperado de sciencedirect.com.
- Teyssen, S. et al. (1999). Maleic acid and succinic acid in fermented alcoholic beverages are the stimulants of gastric acid secretion. J. Clin. Invest. 1999;103(5):707-713. Recuperado de jci.org.
- Flecknell, P. et al. (2015). Preanesthesia, Anesthesia, Analgesia, and Euthanasia. In Laboratory Animal Medicine (Third Edition). Recuperado de sciencedirect.com.
- Chen, D. et al. (2005). Aqueous Polymerization of Maleic Acid and Cross-Linking of Cotton Cellulose by Poly(maleic Acid). Ind. Eng. Chem. Res. 2005, 44, 7921-7927. Recuperado de pubs.acs.org.
- Carver, J.R. (2011). Management of cardiac and pulmonary treatment-related side effects. In Supportive Oncology. Recuperado de sciencedirect.com.
- SerdarÜsümez, NejatErverdi. (2010). Adhesives and Bonding in Orthodontics. In Current Therapy in Orthodontics. Recuperado de sciencedirect.com.
- Dalela, M. et al. (2015). pH-Sensitive Biocompatible Nanoparticles of Paclitaxel-Conjugated Poly(styrene-co-maleic acid) for Anticancer Drug Delivery in Solid Tumors of Syngeneic Mice. ACS Appl Mater Interfaces. 2015 Dec 9; 7(48):26530-48. Recuperado de ncbi.nlm.nih.gov.
- Paudyal, R. et al. (2018). A novel approach in acidic disinfection through inhibition of acid resistant mechanisms; Maleic acid-mediated inhibition of glutamate decarboxylase activity enhances acid sensitivity of Listeria monocytogenes. Food Mycrobiol. 2018 Feb. 69:96-104. Recuperado de ncbi.nlm.nih.gov.
