Reacción endergónica: qué es, características y ejemplos
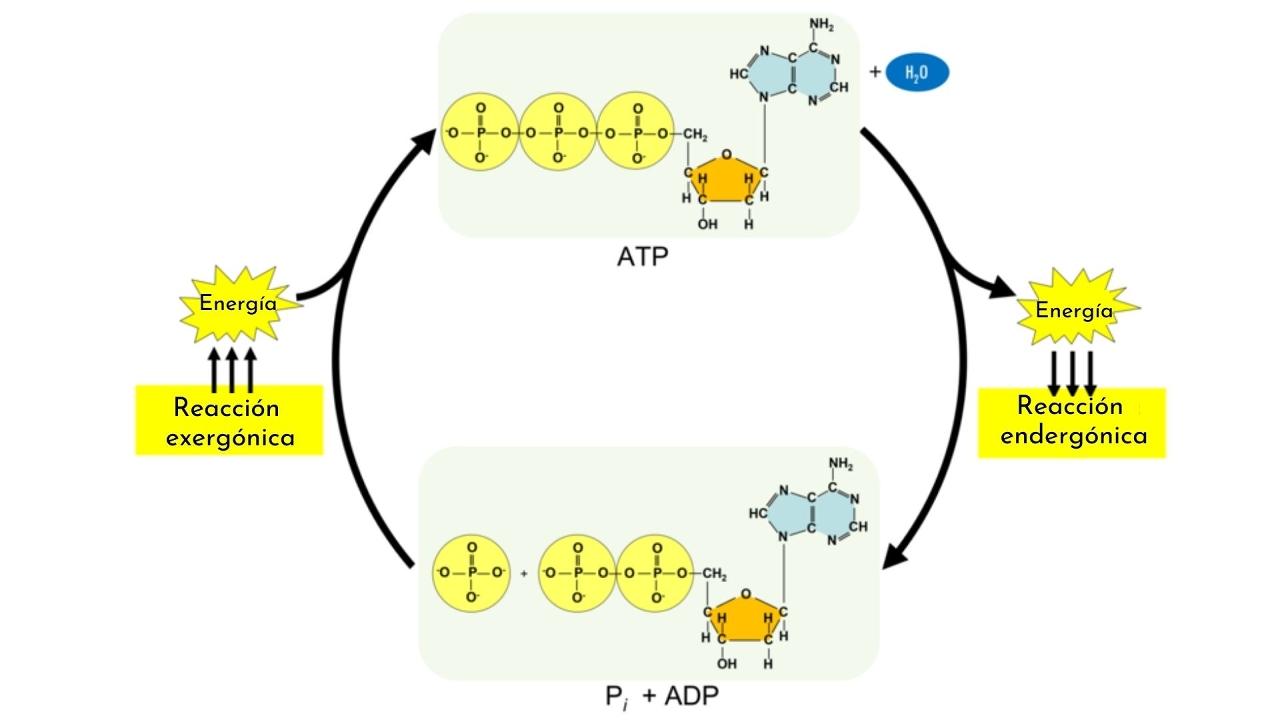
¿Qué es una reacción endergónica?
Una reacción endergónica es aquella que no es espontánea, y requiere además de un alto suministro de energía. En química, esta energía generalmente es la calórica. Las más conocidas entre todas las reacciones endergónicas son las reacciones endotérmicas, es decir, aquellas que absorben calor para producirse.
La razón por la que no todas las reacciones son espontáneas es porque consumen energía, y los sistemas formados por las especies involucradas disminuyen su entropía. En otras palabras, para fines químicos, se tornan molecularmente más ordenadas.
Construir un muro de ladrillos es un ejemplo de una reacción endergónica. Los ladrillos por sí solos no se compactan lo suficiente para formar un cuerpo sólido. Esto se debe a que no hay una ganancia energética que promueva su unión (reflejado también en sus posibles bajas interacciones intermoleculares).
Para construir el muro se necesita de cemento y mano de obra. Esto es energía, y la reacción no espontánea (el muro no se construirá automáticamente) se vuelve posible si se percibe un beneficio energético (económico, en el caso del muro).
De no haber ningún beneficio, el muro se derrumbará ante cualquier perturbación, y sus ladrillos jamás podrán mantenerse unidos. Lo mismo ocurre con muchos compuestos químicos, cuyos bloques de construcción no pueden unirse espontáneamente.
Características de una reacción endergónica
– No es espontánea.
– Absorbe calor (u otro tipo de energía).
La razón es que sus productos poseen más energía que los reactivos involucrados en la reacción. Lo anterior puede representarse con la siguiente ecuación:
ΔG= GProductos-GReactivos
Donde ΔG es el cambio de la energía libre de Gibbs. Como GProducto es mayor (porque es más energético) que GReactivos, la resta debe ser mayor que cero (ΔG>0). La siguiente imagen resume aún más lo recién explicado:

Nótese la diferencia entre los estados energéticos entre los productos y los reactivos (línea morada). Por lo tanto, los reactivos no se transforman en productos (A+B=>C) si primeramente no hay una absorción de calor.
Incrementa la energía libre del sistema
Toda reacción endergónica tiene asociado un incremento de la energía libre de Gibbs del sistema. Si para determinada reacción se cumple que ΔG>0, entonces no será espontánea y requerirá de un suministro de energía para llevarse a cabo.
¿Cómo saber matemáticamente si una reacción es o no endergónica? Aplicando la siguiente ecuación:
ΔG= ΔH–TΔS
Donde ΔH es la entalpía de la reacción, esto es, la energía total liberada o absorbida, ΔS es el cambio de entropía, y T la temperatura. El factor TΔS es la pérdida de energía no aprovechada en la expansión u ordenamiento de las moléculas en una fase (sólida, líquida o gaseosa).
Así, ΔG es la energía que el sistema puede emplear para realizar un trabajo. Como ΔG tiene signo positivo para una reacción endergónica, debe aplicársele energía o trabajo al sistema (los reactivos) para obtenerse los productos.
Entonces, conociendo los valores de ΔH (positivos, para una reacción endotérmica, y negativos, para una reacción exotérmica), y TΔS, se puede saber si la reacción es endergónica.
Esto significa que, aunque una reacción sea endotérmica, nonecesariamente es endergónica.
El cubo de hielo
Por ejemplo, un cubo de hielo funde en agua líquida absorbiendo calor, lo cual ayuda a separar sus moléculas; sin embargo, el proceso es espontáneo y, por lo tanto, no es una reacción endergónica.
En el caso de que se desee fundir el hielo a una temperatura muy por debajo de los -100 °C, el término TΔS de la ecuación de la energía libre se vuelve pequeño comparado a ΔH (porque T disminuye), y como resultado, ΔG tendrá un valor positivo.
En otras palabras: fundir el hielo por debajo de los -100 °C es un proceso endergónico, y no es espontáneo. Un caso similar es el de congelar el agua alrededor de los 50 °C, lo cual no ocurre espontáneamente.
Los enlaces de sus productos son más débiles
Otra característica importante, relacionada también con ΔG, es la energía de los enlaces nuevos. Los enlaces de los productos formados son más débiles que los de los reactivos.
No obstante, la disminución de la fuerza de los enlaces se compensa con una ganancia de masa, lo cual se refleja en las propiedades físicas.
Aquí la comparación con el muro de ladrillos empieza a perder sentido. De acuerdo a lo anterior, los enlaces dentro de los ladrillos deben ser más fuertes que los que hay entre ellos y el cemento. Sin embargo, el muro como conjunto es más rígido y resistente por tener mayor masa.
Está acoplada con reacciones exergónicas
Si las reacciones endergónicas no son espontáneas, ¿cómo tienen lugar en la naturaleza? La respuesta se debe al acoplamiento con otras reacciones que sí son bastante espontáneas (exergónicas) y que de algún modo promueven su desarrollo.
Por ejemplo, la siguiente ecuación química representa este punto:
A + B=> C (reacción endergónica)
C + D=> E (reacción exergónica)
La primera reacción no es espontánea, por lo que naturalmente no podría ocurrir. Sin embargo, la producción de C permite que se produzca la segunda reacción, originando E.
Sumando las energías libres de Gibbs para las dos reacciones, ΔG1 y ΔG2, con un resultado menor que cero (ΔG0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Si C no reaccionara con D, A no podría formarlo jamás, por no haber una compensación energética (como el caso del dinero con el muro de ladrillos). Se dice entonces que C y D “jalan” a A y B para que reaccionen, aun siendo una reacción endergónica.
Ejemplos de reacciones endergónicas
Fotosíntesis
Las plantas utilizan la energía solar para poder crear carbohidratos y oxígeno a partir del dióxido de carbono y agua. El CO₂ y O2, moléculas pequeñas con fuertes enlaces, forman azúcares, de estructuras anillares, que son más pesados, sólidos, y funden a una temperatura alrededor de los 186º C.
Nótese que los enlaces C-C, C-H y C-O son más débiles que los del O=C=O y O=O. Y a partir de una unidad de azúcar, la planta puede sintetizar polisacáridos, como la celulosa.
Síntesis de biomoléculas y macromoléculas
Las reacciones endergónicas forman parte de los procesos anabólicos. Al igual que los carbohidratos, otras biomoléculas, como las proteínas, y los lípidos, requieren de mecanismos complejos que sin ellos, y el acoplamiento con la reacción de hidrólisis del ATP, no podrían existir.
La formación de diamantes y compuestos pesados del crudo
Los diamantes requieren de enormes presiones y temperaturas, para que así, sus componentes puedan compactarse en un sólido cristalino.
Sin embargo, algunas cristalizaciones sí son espontáneas, aunque transcurren a velocidades muy lentas (la espontaneidad no tiene relación con la cinética de la reacción).
Para finalizar, el crudo por sí solo representa un producto de reacciones endergónicas, en especial los hidrocarburos pesados o las macromoléculas denominadas asfaltenos.
Sus estructuras son muy complejas, y la síntesis de las mismas necesitan de mucho tiempo (millones de años), de calor y de la acción bacteriana.
Otros ejemplos
– La respiración celular de las plantas.
– El transporte de oxígeno en el torrente sanguíneo.
– La difusión de iones a través de las membranas celulares.
– La contracción muscular.
– La síntesis proteica celular.
Referencias
- Reacciones endergónicas y exergónicas. Recuperado de quimitube.com
- Energía libre. Recuperado de es.khanacademy.org
- Definition of endergonic reaction. Recuperado de biologydictionary.net
