Carácter metálico: qué es, cómo varía y propiedades
¿Qué es el carácter metálico?
El carácter metálico de los elementos de la tabla periódica se refiere a todas aquellas variables, químicas y físicas, que definen a los metales o los distinguen de otras sustancias de la naturaleza. Por lo general son sólidos brillantes, densos, duros, con altas conductividades térmicas y eléctricas, moldeables y dúctiles.
Sin embargo, no todos los metales exhiben tales características; por ejemplo, en el caso del mercurio, este es un líquido negro brillante. Asimismo, estas variables dependen de las condiciones de presión y temperatura terrestres. Por ejemplo, el hidrógeno, aparentemente no metálico, puede comportarse físicamente como un metal en condiciones extremas.
Estas condiciones pueden ser: bajo presiones abismales o temperaturas muy frías rondando el cero absoluto. Para definir si un elemento es metálico o no, es necesario considerar patrones ocultos a los ojos del observador: los patrones atómicos.
Estos discriminan con mayor precisión y confiabilidad cuáles son los elementos metálicos, e incluso qué elemento es más metálico que otro.
De esta manera, el verdadero carácter metálico de una moneda de oro descansa más en las cualidades de sus átomos que las determinadas por su masa dorada, aun ambas están estrechamente relacionadas.
¿Cuál de las monedas es más metálica: una de oro, una de cobre o una de platino? La respuesta es la de platino, y la explicación reside en sus átomos.
¿Cómo varía el carácter metálico de los elementos en la tabla periódica?
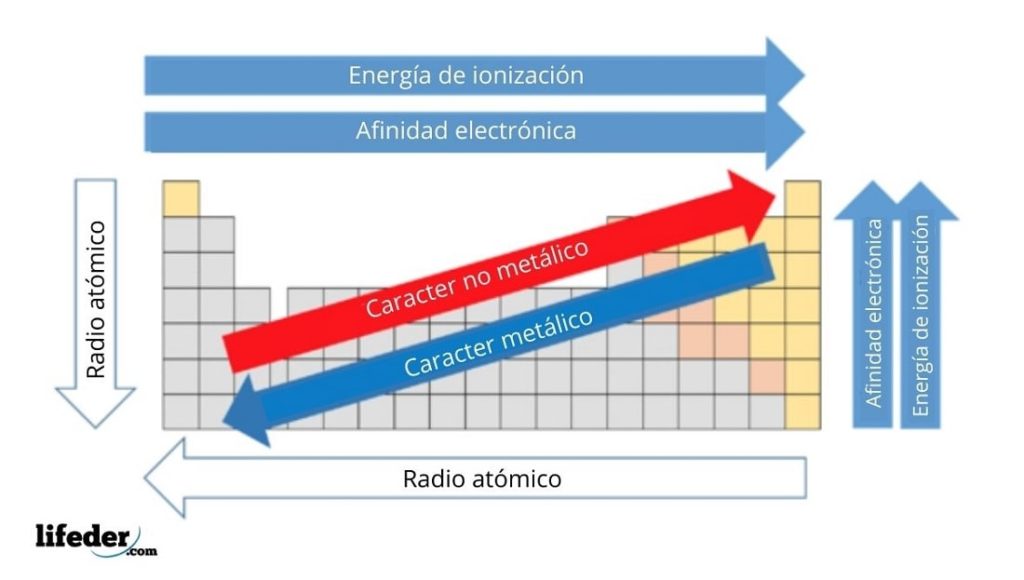
En la imagen superior se tienen las propiedades periódicas de los elementos. Las filas corresponden a los períodos y las columnas a los grupos.
El carácter metálico disminuye de izquierda a derecha de la tabla periódica, y aumenta en sentido contrario. Asimismo, el carácter metálico aumenta de arriba hacia abajo y disminuye a medida que se recorren los períodos hasta los cabezales de grupo.
De este modo, los elementos que se encuentran cerca de la dirección a la que apunta la flecha, tienen mayor carácter metálico que aquellos ubicados en la dirección contraria (los bloques amarillos).
Adicionalmente, las otras flechas corresponden a otras propiedades periódicas, las cuales definen en qué sentido estas aumentan o disminuyen conforme el elemento se “metaliza”. Por ejemplo, los elementos de los bloques amarillos, si bien tienen bajo carácter metálico, su afinidad electrónica y energía de ionización son altas.
En el caso de los radios atómicos, mientras más grandes sean, más metálico es el elemento; esto viene indicado por la flecha azul.
Propiedades de los elementos de carácter metálico
En la tabla periódica se observa que los metales tienen radios atómicos grandes, bajas energías de ionización, bajas afinidades electrónicas y bajas electronegatividades. ¿Cómo memorizar todas estas propiedades?
El punto al que desembocan es la reactividad (electropositividad) que define a los metales, los cuales se oxidan; es decir, pierden electrones con facilidad.
Cuando pierden electrones, los metales forman cationes (M+). Por lo tanto, los elementos con mayor carácter metálico forman cationes con mayor facilidad que aquellos de menor carácter metálico.
Un ejemplo de lo anterior es considerar la reactividad de los elementos del grupo 2, los metales alcalinotérreos. El berilio es menos metálico que el magnesio, y este a su vez es menos metálico que el calcio.
Así sucesivamente hasta llegar al metal bario, el más reactivo del grupo (después del radio, elemento radiactivo).
¿Cómo incide el radio atómico sobre la reactividad de los metales?
A medida que aumenta el radio atómico, los electrones de valencia están más alejados del núcleo, por lo que estos son retenidos con menor fuerza en el átomo.
Sin embargo, si se recorre un período hacia el lado derecho de la tabla periódica, el núcleo agrega protones a su cuerpo, ahora más positivo, el cual atrae con mayor fuerza los electrones de valencia, reduciendo el tamaño del radio atómico. Esto trae como consecuencia una disminución del carácter metálico.
Así, un átomo muy pequeño y con un núcleo muy positivo tiende a ganar electrones en lugar de perderlos (elementos no metálicos), y aquellos que pueden tanto ganar como perder electrones, son considerados metaloides. El boro, el silicio, el germanio y el arsénico son algunos de estos metaloides.
Por otro lado, el radio atómico también aumenta si existe nueva disponibilidad energética para otros orbitales, lo cual ocurre al descender en un grupo.
Por esta razón, al descender en la tabla periódica, los radios se tornan voluminosos y el núcleo se hace incapaz de evitar que otras especies le arrebaten los electrones de su capa externa.
En el laboratorio, con un fuerte agente oxidante —como el ácido nítrico diluido (HNO3)— pueden estudiarse las reactividades de los metales frente a la oxidación.
Del mismo modo, los procesos de formación de sus haluros metálicos (NaCl, por ejemplo) también son experimentos demostrativos de esta reactividad.
Elemento de mayor carácter metálico

La dirección de la flecha azul en la imagen de la tabla periódica conduce a los elementos francio y cesio. El francio es más metálico que el cesio, pero a diferencia de este último, el francio es artificial y radiactivo. Por este motivo, el cesio ocupa el lugar del elemento natural de mayor carácter metálico.
De hecho, una de las más conocidas (y explosivas) reacciones conocidas es la que ocurre cuando un trozo (o gotas) de cesio entran en contacto con el agua.
La alta reactividad del cesio, traducido también en la formación de compuestos mucho más estables, es la responsable de la liberación súbita de energía:
2Cs(s) + 2H2O → 2CsOH(aq) + H2(g)
La ecuación química permite ver la oxidación del cesio y la reducción de los hidrógenos del agua a hidrógeno gaseoso.
Elemento de menor carácter metálico

En el diagonal opuesto, en la esquina superior derecha de la tabla periódica, el flúor (F2, imagen superior) lidera la lista de los elementos no metálicos. ¿Por qué? Porque es el elemento en la naturaleza más electronegativo y el de menor energía de ionización.
Dicho de otro modo, reacciona con todos los elementos de la tabla periódica para formar el ion F– y no F+.
El flúor es muy improbable que pierda electrones en alguna reacción química, muy al contrario de los metales. Es por esta razón que es el elemento de menor carácter metálico.
Referencias
- Lumen, chemistry for non-majors. Metallic and Nonmetallic Character. Recuperado de courses.lumenlearning.com
- Chemistry Assignment. (2018). Electropositivity or Metallic Character. Recuperado de chemistry-assignment.com
- Juan Ramos. Complete list of metals and non metals. Recuperado de sciencetrends.com
- Anne Marie Helmenstine, Ph.D. Metallic Character Properties and Trends. Recuperado de thoughtco.com
